微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某同学如图所示装置进行实验,当滴入液体后出现气球体积缩小了,则使用的固体和液体试剂可能是(?)

A.铜与浓硫酸
B.铁与浓硫酸
C.铝和氢氧化钠溶液
D.二氧化锰和浓盐酸
参考答案:C
本题解析:当滴入液体后出现气球体积缩小了,这说明试剂瓶中压强增大,即反应中有气体生成。 A中反应需要加热,B中发生钝化,C中有氢气生成,D中反应也需要加热,所以正确的答案选C。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题设计新颖,基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:简单
2、填空题 (12分).现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而得到较为纯净的NaNO3。实验流程可用下图表示:
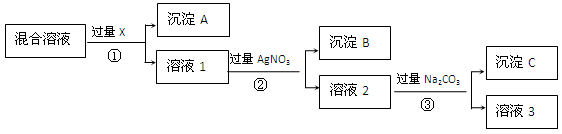
请回答下列问题:
(1)写出实验流程中下列物质的化学式:
试剂X:?,沉淀B:?。
(2)实验流程中加入过量的Na2CO3的目的是?。
(3)实验方案得到的溶液3中肯定含有?(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的?,请写出所发生反应的离子方程式_______________。
参考答案:(1) BaCl2或Ba(NO3)2、AgCl (2) 使溶液中的Ag+、Ba2+完全沉淀(3) Na2CO3、稀HNO3、2H++CO32-==H2O+CO2↑
本题解析:略
本题难度:一般
3、实验题 影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响。
药品:Cu、Fe、Na和不同浓度的硫酸 (0. 5mol/L、2mol/L、18. 4mol/L);
装置如下图
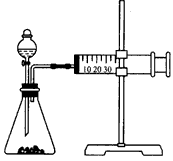
(1)用此装置进行定量实验,应选用的上述实验药品是__;
(2)应该测定的实验数据是___,
(3)此实验忽视了影响反应速率的其他因素是(假设金属颗粒是均匀的)___。
参考答案:(1) Fe、0.5mol/L硫酸、2mol/L硫酸
(2)测定一定时间产生气体的体积(或者测定生成一定体积的气体所需时间)
(3)温度对反应速率的影响
本题解析:
本题难度:一般
4、实验题 某课外活动小组进行下列三组实验(如图所示)。

(1)这三组实验是如何分组的?请写出各组的试管编号:
第一组_______,第二组______第三组_______。你认为如此分组的依据是________________________。
(2)写出试管②⑤⑧的实验现象及有关的离子方程式:
②____________________________;___________________________。
⑤____________________________;___________________________。
⑧____________________________;___________________________。
(3)请作为课外活动小组成员,根据实验及现象的分析、比较,归纳出的结论(至少答3条):
①______________________________________________。
②______________________________________________。
③______________________________________________。
④______________________________________________。
⑤______________________________________________。
参考答案:(1)第一组:①②;第二组:③④⑤⑥;第三组:⑦⑧;因为本实验的目的是研究强酸(盐酸和硫酸)分别与金属氧化物、金属、盐的反应,所以如此分类
(2)②固体溶解,得到蓝色的溶液;CuO+2H+=Cu2++H2O
⑤镁条溶解,产生大量气体;Mg+2H+=Mg2++H2↑
⑧产生白色沉淀;Ba2++SO42-=BaSO4↓
(3)①酸能跟某些金属氧化物反应;②酸能跟某些盐反应;③酸能跟多种活泼金属反应;④酸并不能跟所有金属反应;⑤酸与活泼金属反应时速率不同
本题解析:
本题难度:一般
5、简答题 (一)某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:

(1)浓硫酸的作用是______.
(2)B中观察到的实验现象是______.
(3)从物质性质方面来看,这样的实验设计还存在事故隐患,应如何处理,请画出装置图(填在上图内),用化学方程式表达原理______
(二)新制的氯水含有的分子和离子,现分别做如下实验:
将紫色石蕊试液滴入,溶液显红色,起作用的微粒是______.上述溶液逐渐褪去,起作用的微粒是______.
加入AgNO3溶液,有不溶于稀硝酸的白色沉淀生成,起作用的微粒是______.
(三)在标准状况下,35.5g氯气的体积是______L,将其与氢气完全化合,需氢气的物质的量是______mol,将生成的气体制成1L溶液,溶质的物质的量浓度是______mol?L-1,将此溶液取出20mL加蒸馏水稀释成200mL溶液,此稀稀后的溶液中溶质的物质的量浓度是______mol?L-1.
参考答案:(一)(1)浓硫酸具有吸水性,常用作干燥剂,在实验中吸收气体a中的水蒸气,
故答案为:除去氯气中的水蒸气;
(2)干燥氯气不具有漂白性,装置B中的有色布条不褪色;
故答案为:不褪色;
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收,方程式为Cl2+2NaOH=NaCl+NaClO+H2O,装置图为 ;
;
故答案为: ;Cl2+2NaOH=NaCl+NaClO+H2O;
;Cl2+2NaOH=NaCl+NaClO+H2O;
(二)酸能使紫色石蕊试液变红色,在水溶液里电离出的阳离子全部是氢离子的是酸,所以使紫色石蕊试液变红色的微粒是氢离子;
次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子;
银离子和氯离子能生成不溶于稀硝酸的白色沉淀,所以加入AgNO3溶液,有不溶于稀硝酸的白色沉淀生成,起作用的粒子是氯离子.
故答案为:H+;HClO;Cl-;
(三)在标准状况下,35.5g氯气的体积是V=n×Vm=mM×Vm=35.5g71g/mol×22.4L/mol=11.2L;
由H2~Cl2~2HCl可知n(H2)=n(Cl2 )=35.5g71g/mol=0.5mol;n(HCl)=2n(Cl2 )=1mol;
将生成的气体制成1L溶液,溶质的物质的量浓度是1mol1L=1mol/L;
设稀释后溶液的浓度为C,则1mol/L×20mL=C×200mL,解得:C=0.1mol/L;
故答案为:11.2;0.5;1;0.1.
本题解析:
本题难度:一般