|
高考化学知识点总结《物质组成与性质实验方案的设计》考点预测(2017年强化版)(二)
2017-09-23 23:02:54
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分)黄铁矿的主要成分是FeS2。测定黄铁矿中FeS2含量的两种方法如下图所示:

已知:①王水是由1体积的浓硝 酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。 酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。
②黄铁矿和王水反应的方程式为FeS2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O
请回答下列问题:
(1)简述实验室配制王水的操作过程_____________________________________
________________________________________________________________。
(2)方法一中过滤、洗涤、灼烧都用到的仪器是_______________。
(3)方法二中要判断BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是_________(填代号)
A.BaCl2
B.NaOH
C.Na2SO4
D.HCl
| (4)实验室利用下列装置和试剂制取少量氯化氢气体试剂:①浓硫酸 ②浓盐酸 ③食盐固体

若选用试剂①③,则应选择的装置是___________(填代号,下同);推测发生反应的化学方程式为__________________________________________________;
若选用试剂①②,则宜选择的装置是____________。
(5)方法一中,灼烧时发生反应的化学反应方程式为________________________ ;已知称取黄铁矿样品的质量为1.50g,称得灼烧后固体的质量为0.8g,不考虑操作误差,则该矿石中FeS2的质量分数是________________。
参考答案:(16分,每空2分)
(1)用量筒取3体积的浓盐酸倒入烧杯中,再取1体积的浓硝酸慢慢倒入浓盐酸中,边加边搅拌。
(2)玻璃棒
(3)AC(4A;2NaCl+H2SO4(浓)  Na2SO4+2HCl↑或 NaCl+H2SO4(浓) Na2SO4+2HCl↑或 NaCl+H2SO4(浓)
(5)2Fe(OH)3 Fe2O3+3H2O? 80%或0.80 Fe2O3+3H2O? 80%或0.80
本题解析:略
本题难度:一般
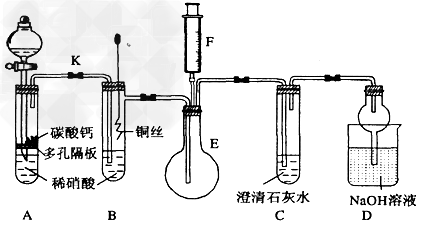
2、实验题 某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是一半空的注射器。
请回答有关问题:
(1)?设计装置A的目的是___________________;为达到此目的,应进行的操作是打开K,且打开分液漏斗活塞,当装置C中产生______________时,关闭K。
(2)?在完成(1)中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是______________; B中反应的离子方程式为:________________________。
(3)?装置E和F的作用是________________;为实现此作用,其操作方法是_____________________________。
(4)?装置D的作用是吸收多余的氮氧化物,防止污染空气,兼有________________的功能。
参考答案:(1)利用生成的二氧化碳将整个装置内的空气赶尽,避免NO和氧气反应生成二氧化氮对气体产物的观察产生干扰;白色沉淀
(2)铜丝表面产生气泡,稀硝酸液面上仍为无色,溶液变为蓝色;3Cu+8H++2NO3-=3Cu2++
2NO↑+4H2O
(3)验证无色气体为NO;将注射器F中的空气推入E中或将E中的无色气体吸入到注射器中
(4)防止溶液倒流
本题解析:
本题难度:一般
3、实验题 工业上将纯净干燥的氯气通入到0.375 mol/L NaOH溶液中得到漂白水。某同学想在实验室探究Cl2的性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与盐酸反应可以制取Cl2。
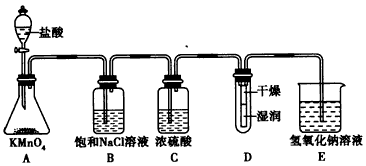
(1)配制物质的量浓度为0.375 mol/L NaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和___________。
(2)浓硫酸的作用是______________________。
(3)装置E中发生反应的离子方程式为______________________________。
(4)装置B中的饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述用饱和NaCl溶液除去Cl2中的HCl气体的原理(用离子方程式表示和文字说明)_______________。
(5)实验时装置D中湿润的部分红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因;如需改进,请简述设计方案(若认为合理,则此问可不作答)___________________。
(6)氯元素含量为10%的漂白水溶液355 g,其中含NaClO的物质的量为___________mol。
参考答案:(1)容量瓶
(2)干燥氯气
(3)Cl2+2OH-=Cl- +ClO- +H2O
(4)HCl溶于水电离出的H+和饱和NaCl溶液中的Cl-都会对反应Cl2+H2O H++Cl-+HClO起到抑制作用 H++Cl-+HClO起到抑制作用
(5)不合理;实验进行中Cl2与湿润的红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色,放置一段时间,由于水分子的运动会导致整个纸条湿润而褪色,取一塑料板将干燥的红色纸条和湿润的红色纸条分别贴在塑料板两侧,将该装置放入装置D中。或将氯气先通入装有干燥的红色纸条的试管,再通入装有湿润的红色纸条的试管中
(6)0.5
本题解析:
本题难度:一般
4、实验题 某同学在学校实验室里发现两瓶失去标签的溶液(标记为A、B),经询问实验员得知是稀硫酸和小苏打(NaHCO3)溶液。为了区分它们,该同学进行了如下实验,请你协助他完成相关问题的解答:
(1)取少量A、B两溶液,分别加入适量Na2CO3,观察到A中有大量气泡,B中没有明显变化现象。A溶液中发生反应的化学方程式是____________________。
(2)取少量A、B两溶液,分别加入几滴酚酞试液,A仍为无色,B为浅红色,分别再逐滴加入过量的NaOH溶液,A中的现象是___________________________,其离子方程式是_________________________________;B中的现象是_________________________,?其离子方程式是___________________________________________________________。
参考答案:(1)H2SO4 + Na2CO3=Na2SO4 + CO2↑+ H2O(3分)
(2)溶液由无色变为红色(1分)? H++ OH-=H2O(3分)
溶液由浅红色变为红色(1分)? HCO3- + OH-=CO32-+ H2O (3分)
本题解析:略
本题难度:简单
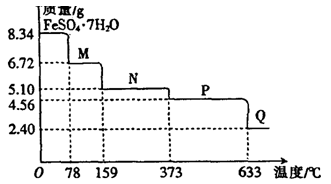
5、实验题 (9分)8.34gFeSO4·7H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定78℃时固体物质M的化学式:??。
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,写出该反应的化学方程式??。
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。
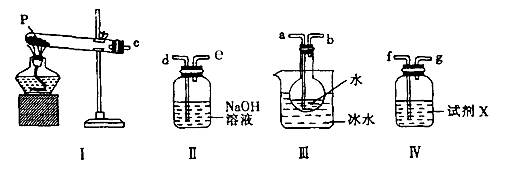
①试剂X的名称是???。
②按气流方向连接各仪器,用字母表示接口的连接顺序:c→ ?。
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止。若最终得到沉淀的质量为Wg,则已分解的P的质量??(填计算式)?。
参考答案:

本题解析:(1)FeSO4·7H2O晶体全部脱去结晶水得到FeSO4时,其质量为

可见物质P为FeSO4
78℃时,FeSO4·7H2O晶体部分脱去结晶水
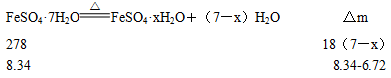
x=4
可见物质M为FeSO4·4H2O
(2)380℃时FeSO4分解为物质Q及两种无色气体,综合题目信息及各相关元素及化合物的性质可假设Q可能为铁的高价氧化物Fe2O3,两种无色气体应该是硫的两种氧化物:SO2、SO3
再通过实验数据进行验证:

假设完全正确
(3)①②按气流方向连接各仪器,用字母表示接口的连接顺序:加热FeSO4分解生成Fe2O3、SO2及SO3,结合两气体物质的性质及检验方法可知,SO2一般用品红溶液来检验,SO3易冷凝,再有就是两气体均可污染空气,所以试剂X为品红溶液,所给装置的连接顺序为:c→a→b→f→g→d
③由关系式2FeSO4~SO3~BaSO4可知,BaSO4的质量为Wg,分解的FeSO4的质量为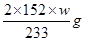
本题难度:简单
| 