微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为?
A.
B.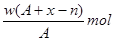
C.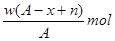
D.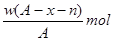
参考答案:C
本题解析:它的阴离子Xn-核外有x个电子,即可得该原子的质子数为x—n;则该原子的中子数为A—(x—n)=A—x+n;w克这种元素的原子物质的量为W/A;即可得w克这种元素的原子核内中子数为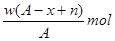
本题难度:简单
2、选择题 下列各微粒中,各个电子层电子数都达到2n2个的是?(?)
A.Ne、Ar
B.Al3+、S2-
C.F- 、Na+
D.Ne、Cl-
参考答案:C
本题解析:各个电子层电子数都达到2n2个,但最外层电子数不大于8个,次外层不大于18个,倒数第三层不大于32个.
当n=1时,电子层只有一个,第一电子层也是其最外电子层,最多排2个电子;
当n=2时,最外层是第二电子层,最多排8个电子,各电子层能达到2n2个电子,所以只要核外电子数是10个的原子或离子都可.
当n=3时,最外层是第三电子层,最多排8个电子,不是各电子层能达到2n2个电子,所以舍去.
所以符合条件的是有2个电子或10个电子的原子或离子.
A、Ar不符合条件,故错误.
B、S2-不符合条件,故错误.
C、F-、Na+各个电子层电子数都达到2n2个,故正确.
D、Cl-不符合条件,故错误.
故选C。
点评:本题考查了原子核外电子的排布,难度不大,注意每个电子层上最多排2n2个,但还要符合最外层电子数不大于8个,次外层不大于18个,倒数第三层不大于32个的规则。
本题难度:一般
3、选择题 有X、Y、Z三种同主族元素,已知最高价氧化物的水化物的酸性强弱顺序是:
H3XO4<H3YO4<H3ZO4。下列推断正确的是
A.元素的非金属性:X>Y>Z
B.原子序数:X>Y>Z
C.气态氢化物的稳定性:XH3>YH3>ZH3
D.气态氢化物的还原性:XH3〈YH3〈ZH3
参考答案:B
本题解析:略
本题难度:一般
4、选择题 下列叙述中正确的是
A.同一主族元素的气态氢化物,其相对分子质量越大,对应的熔、沸点一定越高
B.升高温度可加快反应速率,其主要原因是反应物分子能量增加,单位体积活化分子的数目增多,活化分子的百分数不变,使得有效碰撞次数增多
C.若R2-离子和M+离子的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的pH:NaA<NaB
参考答案:D
本题解析:A、同一主族元素的气态氢化物,其相对分子质量越大,对应的熔、沸点不一定越高,如HF分子间存在氢键,熔沸点大于HCl,错误;B、升高温度可加快反应速率,其主要原因是反应物分子能量增加,单位体积活化分子的数目增多,活化分子的百分数增多,使得有效碰撞次数增多,错误;C、若R2-离子和M+离子的电子层结构相同,则原子序数:R<M ,错误;D、根据盐类水解规律知,若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的pH:NaA<NaB,正确。
本题难度:简单
5、判断题 有A、B、C三种元素,已知5.75 g A单质跟盐酸完全反应,在标准状况下,可产生2.8 L(标准状况下)H2和0.25 mol ACln;B的气态氢化物的分子式是H2B,其相对分子质量与B的最高价氧化物的水化物相对分子质量比为1∶2.88,B核内质子数与中子数相等;C和B可形成CB2液态化合物,并能溶解B的单质,试完成下列问题:
(1)A、B、C的名称;A离子的结构示意图;B在周期表中的位置;CB2的分子式。
(2)用电子式表示A与B形成化合物的过程。
参考答案:(1)A为钠,B为硫,C为碳?钠离子的结构示意图为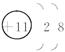 ?第3周期第ⅥA族? CS2
?第3周期第ⅥA族? CS2
(2)
本题解析:设A的相对原子质量为x,化合价为n,依题意有
A+nHCl====ACln? +? H2↑
H2↑
x g? 1 mol? 11.2n L
5.75 g? 0.25 mol? 2.8 L
x=23,n=1,即A为金属钠。
B的氢化物化学式为H2B,设B的相对原子质量为y,则其最高价氧化物对应的水化物化学式为H2BO4。
(y+2)∶(y+66)=1∶2.88,解得y=32,因其核内质子数与中子数相等,质子数=16,故B元素为硫,C与B形成CB2液态化合物,能溶解B的单质,则CB2为CS2,C为碳元素。
本题难度:简单