微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图是化学实验常用装置之一,若气体从右管进入,可用来收集的气体是
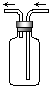
A.NO
B.N2
C.CO
D.SO2
参考答案:D
本题解析:分析图,得:采用向上排空气法收集气体;
说明该气体密度比空气大,即相对分子质量比空气大;但NO易与O2反应生成NO2,即NO不能用排空气法收集,故选D
本题难度:简单
2、实验题 .(12分)在实验室中用二氧化锰跟浓盐酸反应制备干燥且较纯净的氯气。进行此实验,所用仪器如下图:

(1)连接上述仪器的正确顺序是(填各接口处的字母):
?接?,_____接?,_____接?,?接?。
(2)在装置中:
①饱和食盐水的作用是?,
②浓硫酸的作用是?。
(3)写出下列化学反应的化学方程式:
①气体发生装置中进行的反应:?;
②尾气吸收装置中进行的反应:?。
(4)MnO2是______色的粉末状固体,在该实验中MnO2所起得作用是____________
(5)若实验操作正确,在集气瓶内若放一块干燥的有色布条,在实验进行的过程中,有色布条能否褪色?(填“能”或“不能”)________.
参考答案:(共12分)
(1)E?接 C , D接 A , B接 H ,G 接 F。(2分)
(2)①?除去氯气中的HCl气体,(1分)
②除去氯气中的水蒸气,干燥氯气?。(1分)
(3)①:4HCl(浓)+MnO2 ?MnCl2 +Cl2↑ +2H2O;(2分)
?MnCl2 +Cl2↑ +2H2O;(2分)
②:Cl2 + 2NaOH =" NaCl" + NaClO + H2O(2分)
(4)黑,(1分)氧化剂(或类似的意思)(1分)
(5)不能(2分)
本题解析:考查氯气的制取、除杂、干燥及尾气吸收:其中一般用饱和食盐水来吸收氯化氢,浓硫酸来吸水,用碱液来吸收尾气
在实验原理中,MnO2是氧化剂,将盐酸中的氯元素氧化为氯气
干燥、除杂、集气时气体一般是长管进、短管出;
氯气本身并没有漂白性,只有当与水反应生成次氯酸时才具有漂白性,故经干燥后、在集气瓶中收集的氯气没有漂白性
本题难度:一般
3、选择题 下列气体中,不能用排水法收集的是
A.O2
B.NO
C.H2
D.NH3
参考答案:D
本题解析:D项:氨气极易溶于水,只能采用排空气法收集,不能用排水法收集。故选D。
点评:解答本题需要学生应该掌握根据气体的密度和溶解性来选择收集气体的方法。
本题难度:简单
4、实验题 Ⅰ、 四氯化钛是无色液体,沸点为136℃。它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。在650℃~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。下图是某科研小组制备TiCl4的反应装置:
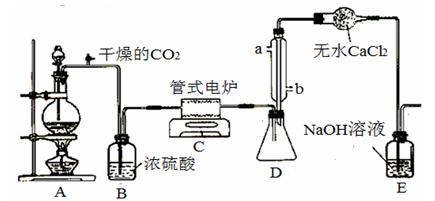
其主要操作步骤如下:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
(1)正确的操作顺序为(填序号) ?;
(2)装置A中的反应的离子方程式为??;
(3)C装置中的反应的化学方程式为??。
Ⅱ、若该科研小组将刚吸收过少量SO2的NaOH溶液注入装置E对上述实验的尾气进行吸收处理,则吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl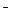 、CO32-、OH
、CO32-、OH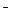 和SO
和SO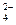 。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解).
。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解).
(1)提出合理假设:
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:?。
(2)设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:
a.3mo l L-1 H2SO4? b.0.01mol
L-1 H2SO4? b.0.01mol ?L-1 KMnO4? c.1mol
?L-1 KMnO4? c.1mol L-1 BaCl2
L-1 BaCl2
d.淀粉—KI溶液? e.酚酞试剂? f.品红溶液
实验步骤
|  预期现象和结论 预期现象和结论
|
步骤1:取少量吸收液于试管中,滴加3 mol L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中。 L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中。
| ?
|
步骤2:向A试管中滴加1~2滴
?(填序号)。
| 若溶液 ?,则假设1成立。
否则,则假设2或3成立。
|
步骤3:向B试管中滴加1~2滴
?(填序号)。
| 若溶液 ?,则假设3成立。
否则,结合步骤2,则假设2成立。
|
?
参考答案:Ⅰ、(1)③①④②
(2)4H++2Cl-+MnO2?="==" Mn2++Cl2↑+2H2O?
(3)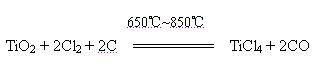
Ⅱ、(1)只存在ClO-
(2)b?褪色? d?变蓝色
本题解析:略
本题难度:简单
5、实验题 某学生用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2-3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2-3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2-3mL处
E.调节液面至“0”或“0”刻度以下,记下读数,为3.10mL
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管的读数。回答下列问题:

(1)正确的操作顺序是:B、?、F(填序号);
(2)上述B步骤操作的目的是?;
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响?
是??(填“偏大”或“偏小”或“无影响”);
(4)判断到达滴定终点的实验现象是?;
(5)若滴定结束时,滴定管液面如图所示,则终点读数为?mL。
(6)根据读数计算出该待测液的浓度为?。
参考答案:(1)D C E A?(2)防止滴定管内壁附着的水将标准溶液稀释而带来误差
(3)偏大?(4)溶液由无色变为浅红色,且半分钟内不褪色
(5)21.10?(6)0.09000mol·L-1
本题解析:(1)用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液时,其正确的操作为用标准氢氧化钠溶液润洗滴定管2-3次,取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2-3mL处,把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液,调节液面至“0”或“0”刻度以下,记下读数,为3.10mL,取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2-3滴酚酞试液,把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管的读数。所以答案为D C E A;(2)中,B步骤操作的目的是防止滴定管内壁附着的水将标准溶液稀释而带来误差;(3)中,若先用待测溶液润洗锥形瓶,则会使测定结果偏大;(4)中,到达滴定终点的实验现象是溶液由无色变为浅红色,且半分钟内不褪色;(5)中,终点读数为21.10,注意小数点的精确位数;(6)中,根据cv=c1v1
可以得到,0.1000×(21.10-3.10)=20c1,解得c1为0.09000mol·L-1。
点评:该题考查了如何配置溶液以及酸碱滴定的相关知识,难度不大,解答该题要注意仪器的读数所精确的位数。
本题难度:一般