微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知某金属硝酸盐,在受热分解时生成了金属氧化物、二氧化氮与氧气。得到的二氧化氮与氧气通入水中,恰好被水完全吸收,试分析该硝酸盐分解时金属化合价的变化情况是(? )?
A.升高
B.降低
C.不变
D.不能确定
参考答案:C
本题解析:根据题意可知,NO2是还原产物,氧气是氧化产物。得到的二氧化氮与氧气通入水中,恰好被水完全吸收,这说明二者恰好反应又生成硝酸,所以根据电子的得失守恒可知,原硝酸盐中金属的化合价是不变的,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生灵活运用氧化还原反应的知识解决实际问题的能力,有利于培养学生的逻辑推理能力和逆向思维能力,提高学生分析问题、解决问题的能力。
本题难度:简单
2、简答题 随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上.部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4
溶解性
可溶
难溶
难溶
易溶
|

请回答下列问题:
(1)23V在元素周期表位于第______周期______族.工业上由V2O5冶炼金属钒常用铝热剂法,其用化学方程式表示为______.
(2)反应①的目的是______.
(3)该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,写出该步发生反应的离子方程式______.
(4)用酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,写出配平后完整的离子方程式.
______VO2++______H2C2O4+______H+→______VO2++______?CO2+______.
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变
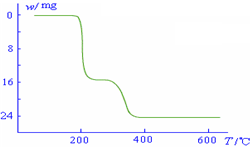
化的曲线如右图所示.则NH4VO3在分解过程中______.
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O.
参考答案:(1)钒核外电子排布式为1s22s22p63s23p63d34s2,处于d区,故钒处于第四周期第ⅤB族;铝与五氧化二钒反应生成钒与氧化铝,反应方程式为3V2O5+10Al??高温?.?6V+5Al2O3,
故答案为:四;VB;3V2O5+10Al??高温?.?6V+5Al2O3;
(2)加入硫酸和亚硫酸钠,目的是利用氧化还原反应,用亚硫酸钠还原V2O5,将V2O5?转化为可溶性的VOSO4,便于提纯,
故答案为:将V2O5?转化为可溶性的VOSO4;
(3)根据NH4VO3难溶于水,利用复分解反应沉淀VO3-,离子方程式为:NH4++VO3-=NH4VO3↓,
故答案为:NH4++VO3-=NH4VO3↓;
(4)测定反应②溶液中钒的含量,可用已知浓度的酸化H2C2O4溶液滴定(VO2)2SO4溶液,主要产物为CO2和VOSO4,根据化合价升降,写出的离子方程为2VO2++H2C2O4+2H+=2?VO2++2?CO2↑+2?H2O,
故答案为:2;1;2;2;2;2H2O;
(5)根据NH4VO3在焙烧变化的图象可知:
2NH4VO3═V2O5+2NH3↑+H2O
234g?34g?18g
减少值开始为0~17g,曲线到200℃时(约为16.0g)曲线开始平直;到约为300℃时又开始减少(H2O的质量),到350℃时减少24g时就不再变化,所以NH4VO3在焙烧过程中200℃时左右先失去氨;在300~350℃再失去水,
故答案为:B.
本题解析:
本题难度:一般
3、选择题 下列说法正确的是
A.一定条件反应:2CO(g)  CO2(g)+C(s)可自发进行,则该反应的△H>0
CO2(g)+C(s)可自发进行,则该反应的△H>0
B.向硫酸亚铁溶液中滴加硫氰化钾溶液产生血红色沉淀说明溶液已变质
C.在反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,当生成1.5mol Cl2时,反应中转移的电子数为2.5NA
D.相同物质的量浓度的下列溶液:①NH4HSO4②NH4Cl③NH3·H2O,水电离程度由大到小的顺序是:①>②>③
参考答案:C
本题解析:A.一定条件反应:2CO(g)  CO2(g)+C(s)可自发进行,则△G<0.由于△S<0,所以则该反应的△H<0。错误。B.Fe3++3SCN-=Fe(SCN)3. Fe(SCN)3是可溶性的血红色的物质。错误。C.在反应KClO3+ 6HCl(浓)=KCl+3Cl2↑+3H2O中,每生成3mol的氯气,转移电子5mol.现在生成了1.5mol Cl2时,所以反应中转移的电子数为2.5NA。正确。D.①NH4HSO4= NH4++H++SO42-。H+对水的电离起到了抑制作用,NH4+对水的电离起到促进作用,但总的来说,抑制作用大于促进作用。水的电离程度减小;②NH4Cl中的铵根离子水解对水的电离起到促进作用,使水的电离程度增大;③NH3·H2O是弱碱,对水的电离起到抑制作用,由于是弱碱所以对水的抑制作用比NH4HSO4小。故相同物质的量浓度的溶液,水电离程度由大到小的顺序是:②>③>①。错误。
CO2(g)+C(s)可自发进行,则△G<0.由于△S<0,所以则该反应的△H<0。错误。B.Fe3++3SCN-=Fe(SCN)3. Fe(SCN)3是可溶性的血红色的物质。错误。C.在反应KClO3+ 6HCl(浓)=KCl+3Cl2↑+3H2O中,每生成3mol的氯气,转移电子5mol.现在生成了1.5mol Cl2时,所以反应中转移的电子数为2.5NA。正确。D.①NH4HSO4= NH4++H++SO42-。H+对水的电离起到了抑制作用,NH4+对水的电离起到促进作用,但总的来说,抑制作用大于促进作用。水的电离程度减小;②NH4Cl中的铵根离子水解对水的电离起到促进作用,使水的电离程度增大;③NH3·H2O是弱碱,对水的电离起到抑制作用,由于是弱碱所以对水的抑制作用比NH4HSO4小。故相同物质的量浓度的溶液,水电离程度由大到小的顺序是:②>③>①。错误。
本题难度:一般
4、计算题 维生素C又称抗坏血酸,广泛存在于水果、蔬菜中,属于外源性维生素,人体不能自身合成,必须从食物中摄取。其化学式为C6H8O6,相对分子量为176.1,由于分子中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,半反应为:
C6H8O6=C6H6O6+2H++2e?jy=0.18V
因此,可以采用碘量法测定维生素C药片中抗坏血酸的含量。具体实验步骤及结果如下:
(1)准确移取0.01667mol/L的K2Cr2O7标准溶液10.00mL于碘量瓶中,加3mol/L H2SO4溶液10mL,10% KI溶液10mL,塞上瓶塞,暗处放置反应5min,加入100mL水稀释,用Na2S2O3标准溶液滴定至淡黄色时,加入2mL淀粉溶液,继续滴定至溶液由蓝色变为亮绿色。平行三次实验,消耗Na2S2O3标准溶液平均体积为19.76mL。
(2)准确移取上述Na2S2O3标准溶液10.00mL于锥瓶中,加水50mL,淀粉溶液2mL,用I2标准溶液滴定至蓝色且30s不褪。平行三次实验,消耗I2标准溶液平均体积为10.15mL。
(3)准确称取0.2205g的维生素C粉末(维生素C药片研细所得)于锥瓶中,加新煮沸过并冷却的蒸馏水100mL,2 mol/L HAc溶液10mL,淀粉溶液2mL,立即用I2标准溶液滴定至蓝色且30s不褪,消耗12.50mL。
(4)重复操作步骤(3),称取维生素C粉末0.2176g,消耗I2标准溶液为12.36mL;称取维生素C粉末0.2332g,消耗I2标准溶液为13.21mL。
根据以上实验结果计算出该维生素C药片中所含抗坏血酸的质量分数。
参考答案:计算过程:先计算出Na2S2O3标准溶液的浓度;然后用Na2S2O3标准溶液标定I2标准溶液的浓度;再根据I2标准溶液的浓度计算抗坏血酸的质量分数。
计算结果:Na2S2O3标准溶液的浓度为0.05062 mol/L;(4分)
I2标准溶液的浓度为0.02494 mol/L;(4分)
抗坏血酸的质量分数平均值为0.2491;(4分)
本题解析:本题所涉及的所有反应均为氧化还原反应,因此滴定的类型为氧化还原滴定。不过在标准溶液的标定(如Na2S2O3、I2水溶液),以及维生素C的滴定过程中,滴定的方式是有区别的。步骤⑴和步骤⑵是标准溶液的标定,其中步骤⑴是置换滴定的方式,即:
Cr2O72- ~ 3I2 ~ 6S2O32-
0.01667mol/L ×10.00mL c(S2O32-)×19.76mL
而I2标准溶液采用的是直接滴定,即
I2?~? 2S2O32-
c(I2)×10.15mL ? c(S2O32-)×10.00mL
通过以上关系,可分别求得两种标准溶液的浓度:Na2S2O3标准溶液的浓度为0.05062 mol/L,I2标准溶液的浓度为0.02494 mol/L。
在维生素C的滴定过程中,根据半反应中得失电子数目,可写出它与I2的关系式:
I2?~? C6H8O6
c(I2)×V?n(C6H8O6)
然后求得维生素C的质量分数,最后通过求平均值的方法,减小偶然误差。
本题难度:一般
5、选择题 在一定温度下,1 mol金属铜与足量某浓度的硝酸完全反应,生成NO2和NO的物质的量之比为1:3,则反应过程中转移的电子为
A.2 mol
B.3 mol
C.4mol
D.5 mo1
参考答案:A
本题解析:在氧化还原反应中电子得失数目相等。所以在一定温度下, 1 mol金属铜与足量某浓度的硝酸完全反应,Cu失去电子2mol,HNO3得到的电子的物质的量也是2mol。即转移的电子数是2mol。
本题难度:一般