|
高考化学试题《未知》高频试题巩固(2017年最新版)(四)
2017-09-23 23:13:49
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将Fe和Cu的混合粉末加入到100 mL 4 mol/L稀硝酸中充分反应后:
(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是?,可能有的阳离子是?。
(2)若反应后的溶液中有Fe3+,则溶液中一定含有的阳离子是?,可能含有的阳离子是?。
(3)如果反应后的溶液中无金属剩余,则加入的金属质量最大为?。
(4)如果加入的Fe和Cu的质量比为7∶8,则使HNO3完全反应的金属最小质量为?。
参考答案:(1)Fe2+ Cu2+
(2)Cu2+ Fe2+或H+
(3)9.6 g
(4)7.2 g
本题解析:本题中要注意的是稀HNO3将铁和铜氧化时的反应顺序:①与Fe反应生成Fe3+;②与Cu反应生成Cu2+;③Fe3+与Fe反应生成Fe2+。(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是Fe2+,可能有的阳离子是Cu2+;(2)若反应后有Fe3+,则此溶液中一定有的阳离子是Cu2+,可能有的阳离子是Fe2+或H+,而这两者不能同时大量存在;(3)由上述的三个过程可知,只发生与铜的反应时所需的金属质量是最大的,由3Cu~8HNO3可解得需Cu的质量最大为9.6 g;(4)因要求金属质量要最小,所以加入的铁要尽量多地耗酸,所以生成的是Fe3+,加入的Fe与Cu的质量比为7∶8,得到两者的物质的量之比为1∶1,根据Fe~4HNO3,3Cu~8HNO3可解得需金属的物质的量各为0.06 mol,从而可得金属的质量为7.2 g。
本题难度:一般
2、填空题 Ⅰ.2011年4月27日某市工商局查获400克袋装中老年补钙营养奶粉1 401包。这种奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是_____,若有0.75 mol的还原剂被氧化,则被还原的氧化剂有_____mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①自来水;②淀粉碘化钾试纸;③淀粉;④白糖;⑤食醋;⑥白酒。进行实验时,必须选用的物质有____________。
(3)某工厂废切削液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂中_____(填序号)能使NaNO2转化为不引起二次污染的N2反应的化学方程式为________________________ (并标出电子转移的数目和方向)。
①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
(4)下列离子在溶液中一定能大量共存的是________。
A.NH Cl- OH- CO Cl- OH- CO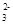
B.Fe2+ NO3- Cl- H+
C.CH3COO- NH H+ Cl- H+ Cl-
D.CH3COO- Na+ Cl- SO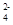
| Ⅱ.实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应式为
4CuI+Hg===Cu2HgI4+2Cu。
(1)上述反应产物Cu2HgI4中,Cu元素是________价。
(2) CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式:
 Cu2++ Cu2++ I-=== I-=== CuI+ CuI+ I I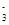
参考答案:Ⅰ(1)NaNO2 0.75 (2)②⑤
(3)② (4)D (4)D
Ⅱ.(1)+1 (2) 2Cu2++5I-===2CuI+I3-
本题解析:Ⅰ(1)根据反应的方程式可知,亚硝酸钠中氮元素的化合价从+3价降低到+2价,得到1个电子,所以亚硝酸钠是还原剂。HI中I元素的化合价从-1价升高到0价,失去1个电子,则根据电子得失守恒可知,若有0.75 mol的还原剂被氧化,则被还原的氧化剂有0.75mol。
(2)根据反应的方程式可知,该反应是在酸性条件下进行的,所以必须选用的物质有淀粉碘化钾试纸和食醋,答案选②⑤。
(3)使NaNO2转化为不引起二次污染的N2,这说明在反应中亚硝酸钠是氧化剂,得到电子,所以选择的应该是还原剂,NH4+中的氮元素处于最低价态,具有还原性,所以选择的试剂是氯化铵,即答案选②,反应的方程式是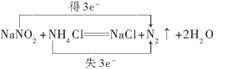 。 。
(4)A中的OH-与NH4+不能大量共存;B中溶液显酸性,则NO3-能氧化Fe2+不能大量共存;C中的CH3COO-和H+不能大量共存,所以答案选D。
Ⅱ.(1)在Cu2HgI4中,Hg显+2价,I是-1价,所以铜是+1价。
(2)在反应中铜的化合价从+2价降低到+1价,得到1个电子,而碘元素碘化合价从-1价升高到0价,失去1个电子,则根据电子的得失守恒可知,配平后的方程式应该是2Cu2++5I-===2CuI+I3-。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是准确标出有关元素的化合价变化情况,然后依据有关的概念,并结合电子得失守恒进行列式计算和判断即可。
本题难度:一般
3、填空题 2.0g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
8 MnO4_ + 5 Cu2S + 44 H+ ="===" 10 Cu2+ + 5 SO2 + 8 Mn2+ + 22 H2O
6 MnO4_ + 5 CuS + 28 H+ ="===" 5 Cu2+ + 5 SO2 + 6 Mn2+ + 14 H2O
(1)上述两个反应具有完全相同的_____________(可多选)
A氧化剂? B还原剂? C氧化产物? D还原产物
(2) 反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.10 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
□MnO4_?+ □Fe2+ + □H+——□Mn2++ □Fe3++ □_______
KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_________mol。
(3)混合物中Cu2S的质量分数为_________%。(写出解题过程)
参考答案:(1)AD?(2)1? 5? 8? 1? 5? 4 H2O? 0.007?(3) 40%
本题解析:略
本题难度:一般
4、判断题 化合物X是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等。年产量达300万吨的氯酸钠是生产X的原料,92%用于生产X—在酸性水溶液中用盐酸、二氧化硫或草酸还原。此外,将亚氯酸钠固体装柱,通入用空气稀释的氯气氧化,也可生产X。X有极性和顺磁性,不形成二聚体,在碱性溶液里可发生歧化反应。
⑴写出X的分子式和共轭π键(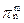 )。 )。
⑵分别写出上述用草酸还原和用氯气氧化生产X的反应方程式。
⑶写出上述X歧化反应的化学方程式。
参考答案:⑴? ClO2?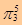
⑵2ClO3-+ H2C2O4 + 2H+ = 2ClO2 + 2CO2 + 2H2O
或 2NaClO3 + H2C2O4 + H2SO4 = 2ClO2 + 2CO2?+ Na2SO4 + 2H2O
2NaClO2+ Cl2 = 2ClO2 + 2NaCl
NaClO2是固体,不能写成ClO2-。
⑶2ClO2 + 2NaOH= NaClO2 + NaClO3 + H2O
或 2ClO2 + 2OH-= ClO2-+ ClO3-?+ H2O
本题解析:⑴根据X的制法:由氯酸钠还原,及亚氯酸钠氧化,可知X是Cl(Ⅳ)的氧化物,即ClO2,同时X的制法也可证明之。
X有顺磁性,成单电子位于形成π键中,所以存在三中心五电子Π键。
⑵利用氧化还原配平方法可配平以上两方程式。但需要注意使用亚氯酸钠制备ClO2时,因为是固相中的反应,因此不能写成离子方程式的形式。
⑶在碱性溶中,Cl(Ⅳ)岐化生Cl(Ⅴ)和Cl(Ⅲ),生成ClO2-和ClO3-离子,然后利用氧化还原方程式的配平方法,配平该反应方程式。
本题难度:一般
5、填空题 (13分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途。
(1)在定向爆破中,常利用氧化铁与铝反应放出的热量来切割钢筋,该反应的化学方程式为__。
(2)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s)?△H=+468.2 kJ·mol-1
C(s)+O2(g)=CO2(g) △H="-393.5" kJ·mol-1。
则Fe(s)与O2 (g)反应生成Fe2 O3 (s)的热化学方程式为______________________。
(3)可用KMnO4溶液滴定Fe2+的浓度,反应的离子方程式如下:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①KMnO4溶液应盛放在_____滴定管中;
②判断达到滴定终点的现象是_____;
③用硫酸酸化的0.020 00 mol·L-1。KMnO4溶液滴定某FeSO4溶液至终点,实验数据记录如下表:
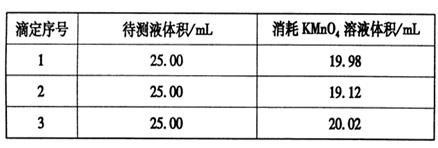
请分析数据并计算,该FeSO4溶液的物质的量浓度为_____。
(4)新型纳米材料ZnFe2Ox,可用于除去工业废气中的某些氧化物。制取新材料和除去废气的转化关系如下图:

①已知ZnFe2O4与H2反应的物质的量之比为2:1,则ZnFe2Ox中x=_____;
②用ZnFe2Ox除去SO2的过程中,氧化剂是_____。
参考答案:(1)Fe2O3+2Al Al2O3+2Fe (2)4Fe(s)+3O2 (g)=2Fe2O3(s) △H=-1648.7kJ/mol Al2O3+2Fe (2)4Fe(s)+3O2 (g)=2Fe2O3(s) △H=-1648.7kJ/mol
(3)①酸式?②溶液恰好变浅紫红色,且半分钟内不褪色 ③0.080 00 mol·L-1
(4)①3.5?②SO2
本题解析:(1)氧化铁与铝反应发生的是铝热反应,方程式为Fe2O3+2Al Al2O3+2Fe; Al2O3+2Fe;
(2)已知:①2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s)?△H=+468.2 kJ·mol-1、②C(s)+O2(g)=CO2(g) △H="-393.5" kJ·mol-1。则根据盖斯定律可知②×3-①即得到反应4Fe(s)+3O2 (g)=2Fe2O3(s),所以该反应的反应热△H=-393.5 kJ/mol×3-468.2 kJ/mol=-1648.7kJ/mol;
(3)①酸性KMnO4溶液具有强氧化性和酸性,应盛放在酸式滴定管中;
②由于酸性高锰酸钾溶液显紫红色,所以判断达到滴定终点的现象是溶液恰好变浅紫红色,且半分钟内不褪色;
③根据表中数据可知,第二次实验中消耗高锰酸钾溶液的体积与其余二次相差较大,舍去不用,因此消耗高锰酸钾溶液的体积平均值为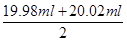 =20.00ml,所以根据方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知,FeSO4溶液的物质的量浓度为 =20.00ml,所以根据方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知,FeSO4溶液的物质的量浓度为 ×5=0.080 00 mol·L-1。 ×5=0.080 00 mol·L-1。
(4)①已知ZnFe2O4与H2反应的物质的量之比为2:1,则根据原子守恒可知,反应中还生成1分子水,所以ZnFe2Ox中x=(4×2-1)÷2=3.5;
②在ZnFe2Ox中铁元素的化合价是+2.5价,而反应后变为+3价,化合价升高,失去电子,做还原剂,因此氧化剂是二氧化硫。
本题难度:困难
|  Cu2++
Cu2++ I-===
I-=== CuI+
CuI+ I
I