微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液一定现中性的是
A.PH=7的溶液
B.c(H+)=10-7mol/L的溶液
C.酸碱恰好完全中和的溶液
D.c(H+)= c(OH-)=3.5×10-7mol/L的溶液
参考答案:D
本题解析:主要溶液中氢离子浓度等于OH-浓度,溶液就一定是呈中性的,答案选D。
点评:溶液酸碱性的判断,主要是看溶液中氢离子浓度和OH-浓度的相对大小。即如果c(H+)= c(OH-),溶液就呈中性,如果c(H+)>c(OH-),溶液就显酸性,如果c(H+)< c(OH-),则溶液就呈碱性,pH=7或c(H+)=10-7mol/L的溶液均指在常温下才能成立。
本题难度:一般
2、选择题 下列说法正确的是:?
A.将氯化铝和硫酸铝溶液蒸干灼烧后均得到氧化铝
B.向足量饱和石灰水中加入0.56 g CaO,可得固体0.74 g
C.由H+(aq)+OH-(aq)===H2O(l);△H=-57.3kJ·mol-1可知,若将含1 mol
CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ
D.向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸钠水解呈碱性
参考答案:C
本题解析:氯化铝溶液灼烧由于铝离子发生水解会产生氢氧化铝,由于氯化氢具有挥发性,会使平衡向水解方向移动,氢氧化铝失水产生氧化铝,但是硫酸没有挥发性,所以灼烧硫酸铝溶液不会得到氧化铝,A错误;饱和石灰水中加入氧化钙,氧化钙会与水反应生成氢氧化钙7.4g,但是溶液是饱和的溶液原溶液中也会析出溶质所以固体的质量大于7.4gB错误;向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸的电离平衡向左移动溶液中氢离子溶液减小,D错误;醋酸是弱酸电离吸热,所以1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ,C正确,答案选C。
本题难度:一般
3、填空题 常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的Ph值的变化关系如右图所示。
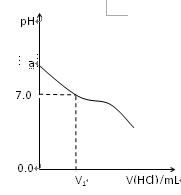
(1) a >7.0的理由是(用离子方程式表示)?
(2)如图,当加入稀盐酸的体积为V1mL时,溶液的pH值刚好为7.0。此时溶液中c(Cl-)?c(CH3COOH)(填<、>或=)。简要写出判断依据?
(3)当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 ?mol/L,求CH3COH的电离平衡常数Ka(计算结果保留两位有效数字)。
参考答案:(1)CH3COO- + H2O  ?CH3COOH + OH-?(3分)
?CH3COOH + OH-?(3分)
(2) ="?" (2分) 根据电荷守恒有:c(OH- ) + c(Cl- ) + c(CH3COO- ) = c(H+) + c(Na+) 由于溶液的pH=7,c(OH- ) = c(H+),所以c(Cl- ) + c(CH3COO- ) = c(Na+)(2分);而根据物料守恒有:c(CH3COO H) + c(CH3COO- ) ="?" c(Na+)(1分)?所以有c(CH3COO H) = c(Cl- )(1分)
(3)解:当加入盐酸的体积为20.0mL时,两种物质刚好完全反应,生成c(CH3COOH) =" 0.10mol/L?"
CH3COOH  ?CH3COO- + H+
?CH3COO- + H+
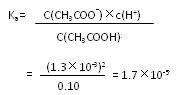
本题解析:略
本题难度:简单
4、选择题 下列热化学方程式中ΔH代表燃烧热的是
A.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH1
B.S(s)+3/2O2(g)=SO3(s)ΔH2
C.CH4(g)+3/2O2(g)=2H2O(l)+CO(g)ΔH 3
D.2CO(g)+O2(g)=CO2(g)ΔH4