微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
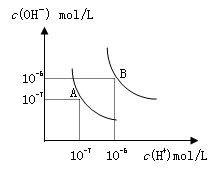
A.纯水中25℃时的c(H+)比100℃时的c(H+)大
B.100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3
C.将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1
D.25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1
参考答案:D
本题解析:A、水的电离为吸热反应,升高温度,水的电离程度增大,氢离子浓度增大,所以纯水中25°C时的c(H+)比100℃的时c(H+)小,错误;B、根据题给图像知,100℃时水的离子积为10-12,由水电离产生的c(H+)=1×10-11mol?L-1,若溶液为酸性溶液,氢离子浓度为:0.1mol/L,溶液的pH=1;若溶液为碱性溶液,则溶液中氢离子浓度为1×10-11mol?L-1,溶液pH=11,错误;C、100℃时水的离子积为10-12,混合溶液的pH=7,反应后的溶液为碱性溶液,溶液中氢离子浓度为1×10-7mol?L-1,氢氧根离子浓度为1×10-5mol?L-1; pH=9的Ba(OH)2溶液中氢氧根离子浓度为1×10-3mol?L-1,与pH=4的稀盐中氢离子浓度为1×10-4mol?L-1,设氢氧化钡的体积为x,盐酸溶液的晶体为y,则:(10?3x?10?4y)/(x+y) =1×10-5,解得x:y=1:10,错误;D、25℃时,氢离子浓度为1.0×10-7mol/L,钠离子浓度为1.0×10-3mol/L,则溶液中c(Na+):c(OH-)=1.0×10-3mol/L:1.0×10-7mol/L=104:1,正确。
本题难度:一般
2、选择题 2011年7月21日,世界各国领导人在南非德班共同商讨应对气候变化的道路——“拯救人类的最后机会”。要想节能减排下列属最有希望的新能源是(? )
①天然气;②煤;③石油;④水能;⑤太阳能;⑥地热能;⑦风能;⑧氢能
A.①②③④
B.⑤⑥⑦⑧
C.③④⑤⑥
D.除①②外
参考答案:B
本题解析:①天然气;②煤;③石油是传统的化石能源,不是新能源,④水能;⑤太阳能;⑥地热能;⑦风能;⑧氢能则可能减少CO2气体的排放,可以达到节能减排的目的,因此属最有希望的新能源。分析选项正确的应该是B。
本题难度:一般
3、选择题 下列溶液一定呈中性的是(?)
A.c(OH-) = 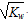 的溶液
的溶液
B.pH=7 的溶液
C.c(H+) =10-14的溶液
D.加甲基橙呈黄色的溶液
参考答案:A
本题解析:A、kw=c(H+)c(OH-), c(OH-) = 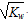 ,故溶液为中性;
,故溶液为中性;
B、如果不在25℃,该溶液不为中性,
C、该溶液可能为碱性;
D、甲基橙的变色范围为3.1~4.4,大于4.4为黄色。
本题难度:简单
4、填空题 某地的酸雨中,含c (Na+) = 7.0×10-6mol/L,c (Cl-) = 4.5×10-5 mol/L,c (NH4+) = 2.3×10-5 mol/L,c (SO42-) = 2.5×10-6 mol/L,则该地酸雨的pH约为?。.
参考答案:4.7
本题解析:根据电荷守恒可知,氢离子浓度是4.5×10-5 mol/L+2.5×10-6 mol/L×2-7.0×10-6mol/L-2.3×10-5 mol/L=2.4×10-5 mol/L,所以pH=4.7。
本题难度:一般
5、填空题 (4分)某工厂甲、乙两车间,分别排放的污水中含有大量的Ag+、Ba2+、Fe3+、Na+、Cl-、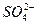 、
、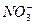 、OH-中的四种。若各自单独排放会造成较大污染,如果混合后再排放,则会大大降低污染程度。现测得甲车间排放的污水呈碱性。则
、OH-中的四种。若各自单独排放会造成较大污染,如果混合后再排放,则会大大降低污染程度。现测得甲车间排放的污水呈碱性。则
(1)甲车间污水中含有的四种离子可能是___________________________。
(2)乙车间污水中含有的四种离子可能是___________________________。
参考答案:(1)OH-、Cl-、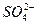 、Na+
、Na+
(2)Ag+、Ba2+、Fe3+、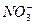
本题解析:根据离子能否大量共存和甲车间排放的污水呈碱性可以判断出甲车间污水和乙车间污水中分别含有哪些离子。
本题难度:简单