微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关物质的性质与应用不踿 相对应的是?
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.FeCl3溶液能与Cu 反应,可用于蚀刻印刷电路
C.SO2具有氧化性,可用于漂白纸浆
D.Zn 具有还原性和导电性,可用作锌锰干电池的负极材料
参考答案:C
本题解析:A选项正确,常用铝离子水解性质用铝盐净化水;B选项正确,Fe3+有氧化性,会腐蚀铜;C选项错误,漂白纸浆不是利用SO2的氧化性;D选项正确,电池中锌是被氧化,是还原剂,作电极还利用其导电性。
【考点定位】物质的性质与应用
本题难度:一般
2、填空题 明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
 焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是________。

(3)Al2O3在一定条件下可制得AlN,其晶体结构如右图所示,该晶体中Al的配位数是________。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ/mol;
2SO3(g) ΔH1=-197 kJ/mol;
H2O(g)=H2O(l) ΔH2=-44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3=-545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是________。焙烧948 t明矾(M=474 g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。
参考答案:(1)S(硫) (2)蒸发结晶 (3)4
(4)Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2
(5)SO3(g)+H2O(l)=H2SO4(l) ΔH=-130 kJ/mol 432
本题解析:结合流程图,根据物质的溶解性去分析解决问题。(1)根据焙烧明矾的化学方程式中各元素的化合价可知,明矾中部分硫元素的化合价降低,而硫单质在反应中元素的化合价升高,故还原剂为单质硫。(2)从滤液中得到晶体的方法为蒸发结晶。(3)由图中的晶体结构可以看出每个Al原子的周围距离相等且最近的N原子有4个,故其配位数为4。(4)放电时Al作负极,失电子被氧化,NiO(OH)在正极得电子,反应的方程式为Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2。(5)给题中的三个热化学方程式分别编号为①、②、③,根据盖斯定律由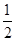 (③-①)-②可得到目标热化学方程式;设可生成硫酸的质量为x吨,据题意列式得到
(③-①)-②可得到目标热化学方程式;设可生成硫酸的质量为x吨,据题意列式得到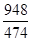 ×
×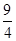 ×96%=
×96%=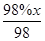 ,故x=432。
,故x=432。
点拨:知识:氧化还原反应、实验基本操作、原子配位数、原电池电池反应方程式、热化学方程式。能力:考查考生框图推断能力、读图识图分析图像能力、知识应用能力。试题难度:较大。
本题难度:一般
3、填空题 甲、乙、丙三种物质之间有如下图所示的转化关系,其中甲物质为氧化物:
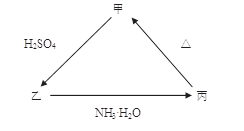
(1)若甲是不溶于水的白色固体,但既能溶于硫酸又能溶于氢氧化钠溶液, 写出下列转化的方程式:
乙 丙的离子方程式______________________; 丙
丙的离子方程式______________________; 丙 甲的化学方程式____________________。
甲的化学方程式____________________。
(2)若向乙溶液中加入KSCN溶液,混合溶液呈红色,则甲物质是________(填化学式)。 甲 乙的离子方程式是_____________________________。
乙的离子方程式是_____________________________。
参考答案:(1)AI3+ + 3NH3 ? H2O = AI(OH)3↓ + 3NH4+?2AI(OH)3 ?AI2O3 + 3H2O
?AI2O3 + 3H2O
(2)Fe2O3? Fe2O3+6H+ =2Fe3+ + 3H2O
本题解析:(1)氧化物甲是不溶于水的白色固体,既能溶于硫酸又能溶于氢氧化钠溶液的是Al2O3.乙是Al2(SO4)3, 丙是Al(OH)3。乙→丙的离子方程式:AI3+ + 3NH3 ? H2O = AI(OH)3↓ + 3NH4+?丙→甲的化学方程式?2AI(OH)3 AI2O3 + 3H2O.(2) 若向乙溶液中加入KSCN溶液,混合溶液呈红色,说明溶液中含有Fe3+,则甲:Fe2O3;乙:Fe2(SO4)3;丙:Fe(OH)3. 甲→乙的离子方程式是Fe2O3+6H+ =2Fe3+ + 3H2O.
AI2O3 + 3H2O.(2) 若向乙溶液中加入KSCN溶液,混合溶液呈红色,说明溶液中含有Fe3+,则甲:Fe2O3;乙:Fe2(SO4)3;丙:Fe(OH)3. 甲→乙的离子方程式是Fe2O3+6H+ =2Fe3+ + 3H2O.
本题难度:一般
4、选择题 某同学将一块铝箔用砂纸仔细打磨,除去表面的保护膜,用坩埚钳夹住放在酒精灯火焰上加热至熔化,发现熔化的铝并不滴落,而是好像有一层膜兜着.对该现象的说法错误的是( )
A.兜着液体的这层膜是氧化铝
B.该实验说明了氧化铝的熔点高于铝的熔点
C.铝极易与空气中的氧气反应在表面形成氧化物保护膜
D.铝的化学性质较稳定,即使加热到熔化也不与空气中的氧气反应
参考答案:将铝箔用坩埚钳夹住放在酒精灯火焰上加热,铝和氧气反应生成了氧化铝,又因三氧化二铝的熔点高于铝的熔点,而三氧化二铝在铝的表面,所以加热铝箔的时候铝熔化了但是不会滴落.故选:D.
本题解析:
本题难度:简单
5、选择题 下列关于金属铝的叙述中,说法正确的是( )
A.Al?是地壳中含量最多的金属元素
B.Al在常温下与空气不反应
C.与Al反应产生H2的溶液一定呈酸性
D.Al箔在空气中受热可熔化,由于氧化膜的存在,熔化的Al并不滴落
参考答案:A、地壳中元素含量最高的是氧元素,铝是地壳中元素含量最高的金属元素,故A正确;
B、Al在常温下与浓硫酸发生钝化现象,发生化学反应,生成一层致密的氧化物保护膜,阻止内部金属与浓硫酸继续反应,故B错误;
C、与Al反应产生H2的溶液可能呈酸性,也可能呈碱性,故C错误.
D、铝和氧气反应在Al箔表面生成了致密的氧化铝膜,氧化铝的熔点高于铝的熔点,加热铝箔的时铝熔化了,但是氧化铝膜兜着熔化的铝不会滴落,故D正确.
故选AD.
本题解析:
本题难度:简单