微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氯碱工业中关于电极材料的选用,下列说法合理的是? ( )。
A.两极可用任意可导电固体材料
B.阳极必须用惰性电极
C.阴极必须用惰性电极
D.石墨阳极比金属阳极更节电
参考答案:B
本题解析:阳极发生氧化反应,反应式为2Cl--2e-=Cl2↑,故阳极需用惰性电
极,阴极则不必。惰性金属阳极比石墨阳极在耐腐蚀性、节电等方面性能更
好。
本题难度:一般
2、填空题
电化学原理在工业生产中有着重要的作用,请利用所学知识回答有关问题。
(1)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。如是电解产生多硫化物的实验装置:
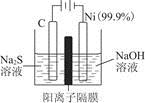
①已知阳极的反应为(x+1)S2-=Sx+S2-+2xe-,则阴极的电极反应式是____________________________
当反应转移x mol电子时,产生的气体体积为____________(标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子反应方程式表示):___________________________。
(2)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为______________________。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为_______________________,

当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为________,MnO2的理论产量为________g。
(3)用图电解装置可制得具有净水作用的 。实验过程中,两极均有气体产生,Y极区溶液逐渐生成
。实验过程中,两极均有气体产生,Y极区溶液逐渐生成
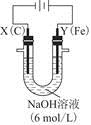
①电解过程中,X极区溶液的pH________(填“增大”“减小”或“不变”)。
②电解过程中,Y极发生的电极反应为Fe-6e-+8OH-= +4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
+4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
参考答案:
(1)①2H2O+2e-=2OH-+H2↑(或2H++2e-=H2↑) 11.2xL
②2S2-+O2+2H2O=2S↓+4OH-
(2)Mn2+-2e-+2H2O=MnO2+4H+
Pb+PbO2+2H2SO4=2PbSO4+2H2O
2 mol 87
(3)增大 4OH--4e-=2H2O+O2↑ 0.28
本题解析:
(1)电解时,水电离的H+在阴极发生得电子还原反应,生成H2。根据电子守恒可知有x mol电子转移,产生H2 0.5x mol。S2-具有较强还原性,易被空气中的氧气氧化,故配制溶液时需要氮气作保护气。
(2)根据题意Mn2+失电子生成MnO2,产物中的氧元素来源于水,生成H+,再将电极方程式配平即可。
(3)图中X极的电极反应为2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-),所以X极区的pH增大,由生成氢气672 mL,可知得电子数为0.06 mol,Y极生成氧气为168 mL,失电子数0.03? mol,由得失电子守恒可知铁失电子数为0.03 mol,由电极反应可知铁溶解为0.005 mol,即0.28 g。
本题难度:一般
3、选择题 高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是?

A铁是阳极,电极反应为Fe-6e一+4H2O=FeO42-+ 8H+
B电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C若隔膜为阴离子交换膜,则OH-自右向左移动
D电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
参考答案:D
本题解析:铁是阳极,溶液呈碱性,不可能生成H+,A错;电解时电子的流动方向是,负极→Ni电极,溶液中是离子导电,再者是Fe→正极,B错;因阳极消耗OH-,所以OH-通过阴离子交换膜自左向右移动,C错;电解时阳极消耗OH-而使附近的pH降低,阴极周围因生成OH-向右侧移动而pH升高,因总反应的消耗OH-,撤去隔膜混合后,与原溶液比较pH降低,D正确。
本题难度:一般
4、选择题 电浮选凝聚法是工业上采用的一种污水处理方法.图3 是电解污水的实验装置示意图,实验用污水中主要含有可被吸附的悬浮物(不导电)。下列有关推断明显不合理的是?
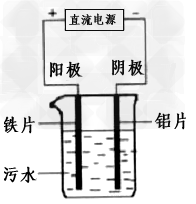
[? ]
A.阴极的电极反应式为: ?
?
B.通电过程中烧杯内产生可以吸附悬浮物的Fe(OH)3? ?
C.通电过程中会产生气泡,把悬浮物带到水面形成浮渣弃去 ?
D.如果实验用污水导电性不良,可加入少量Na2SO4?固体以增强导电性
参考答案:A
本题解析:
本题难度:一般
5、填空题 (10分)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=_1275.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=_556.0kJ?mol-1
③H2O(g)=H2O(l)△H=-44.0kJ?mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________________。
(2)某同学利用甲醇(酸性)燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如下图)。通电后,下图竖直装置下端B极上有大量气泡产生,溶液中产生大量的Fe(OH)2白色沉淀,且较长时间不变色。则电源中b极为______极(填“正”或“负”),其电极反应式为__________________,装置上端A极电极材料是: ____(填化学式),B电极上的电极反应式为____________。
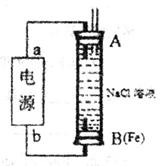
(3)利用电解法在铁制品上镀铜可以防止铁被腐蚀,以下说法正确的是_____。
a.电镀时,通常用铜做阳极,可溶性铜盐作电解质溶液
b. 电镀过程中,维持电流恒定,温度升高,电解反应速率加快
c.电镀过程中,电能全部转化为化学能
d.电镀过程中,铜离子向阴极移动,发生还原反应
参考答案:(1)CH3OH(l)+O2(g)→ CO(g)+2H2O(l)△H="-442.8" kJ?mol-1(2分)
(2)负(1分) CH3OH-6e-+H2O=CO2+6H+(2分) Fe(1分) 2H++2e-=H2↑(2分)(3)ad(2分)
本题解析:(1)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=_1275.6kJ?mol-1,②2CO(g)+O2(g)=2CO2(g)△H=_556.0kJ?mol-1,③H2O(g)=H2O(l)△H=-44.0kJ?mol-1,依据热化学方程式和盖斯定律(①-②+③×4)÷2得到CH3OH(l)+O2(g)="CO" (g)+2H2O(l)△H=_442.8 kJ?mol-1;
(2)甲醇燃料电池为电源电解法制取Fe(OH)2的实验装置,通电后,溶液中产生大量的白色沉淀,且较长时间不变色,说明氢氧化亚铁在B电极附近生成,所以电极A为电解池的阳极,B为电解池的阴极,电源a为正极,电极反应为氧气得到电子得到电子发生还原反应,O2+4e-+2H2O=4OH-;连接正极的A电极是铁,目的是铁做阳极失电子生成亚铁离子,和阴极生成的氢氧根离子反应生成白色沉淀氢氧化亚铁;b为负极,甲醇失去电子,电极反应式为CH3OH-6e-+H2O=CO2+6H+,连接电极B电极反应为:2H++2 e-=H2↑;
(3)a.铁上镀铜时,通常用铜做阳极,可溶性铜盐作电解质溶液,正确;b. 电镀过程中,维持电流恒定,温度升高,电阻增大,电解反应速率减小,错误;c.电镀过程中,电能没有全部转化为化学能,部分转化为热能,错误;d.电镀过程中,铜离子向阴极移动,发生还原反应,正确,答案选ad。
考点:考查热化学方程式和盖斯定律计算应用,原电池,电解池原理分析
本题难度:困难