微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 工业上常以赤铁矿石(主要成分为Fe2O3)和焦炭为主要原料,在高温下炼铁.焦炭产生CO的反应是:
C+O2
CO2;? C+CO2?2CO
(1)CO还原赤铁矿的化学方程式是______
(2)下列说法正确的是______
a.为使赤铁矿石充分燃烧,需将其粉碎
b.足量的空气能提高炼铁反应速率
c.与生铁相比较,纯铁转化为“铁水”的温度低
(3)生铁的用途很多,某电镀厂用生铁将废水中的Cr2O72-转化为Cr3+,流程图1:
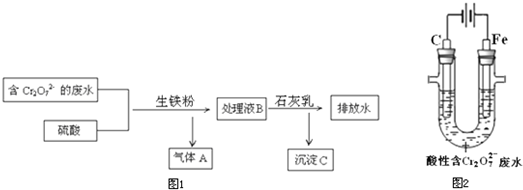
①气体A是______
②在上述酸性溶液中,生铁比纯铁产生Fe2+的速率快,原因是______
③将Cr3+转化为Cr(OH)3的离子方程式是______
(4)电解法将一定浓度的酸性废水中的Cr2O72-转化为Cr3+,其原理示意图2:
①阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式是______
②一段时间后,试管底部出现沉淀.解释生成沉淀的原因:______.
参考答案:(1)一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,故答案为:Fe2O3+3CO?高温?.?2Fe+3CO2;
(2)a、原料铁矿石是固体、空气是气体,为了加快反应速率,所以要将黄铁矿粉碎,增大接触面,提高反应速率,故a正确;
b、采用空气过量目的是增大氧气浓度,提高一氧化碳的浓度,提高炼铁反应速率,故b正确;
c、生铁是合金,熔点低,故c错误;
故答案为:a?b;
(3)①铁与硫酸反应生成H2,故答案为:H2;
②生铁中含有C,铁和碳在硫酸溶液中形成原电池,故答案为:生铁中含有C,在硫酸溶液中形成无数微小原电池,加快反应速率;
③Cr3+与石灰乳反应生成Cr(OH)3是沉淀,离子方程式是2Cr3++3Ca(OH)2═2Cr(OH)3↓+3Ca2+,故答案为:2Cr3++3Ca(OH)2═2Cr(OH)3↓+3Ca2+;
(4)①铁作阳极,电极本身被氧化,反应式为Fe-2e-═Fe2+,溶液呈酸性,H+离子在阴极放电生成氢气,反应式为2H++2e═H2↑,Fe2+离子与Cr2O72-离子发生氧化还原反应生成Fe3+离子和Cr3+离子,反应离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,故答案为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O;
②随着电解进行,c(OH-)浓度增大,生成Fe(OH)3和Cr(OH)3沉淀,故答案为:随着电解进行,溶液中c(H+)?逐渐减少,c(OH-)浓度增大,生成Fe(OH)3和Cr(OH)3沉淀;
本题解析:
本题难度:一般
2、选择题 在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用
[? ]
A.NaOH
B.HCl
C.NaCl
D.CuSO4
参考答案:A
本题解析:
本题难度:一般
3、选择题 Cu2O是一种半导体材料,用作制造整流器的材料,还可以用于制船底防污漆(杀死低级海生动物)、农作物的杀菌剂。在实验室里可模拟工业过程制取Cu2O,总反应式是2Cu+H2O Cu2O+H2↑,其装置如图,下列有关说法不正确的是
Cu2O+H2↑,其装置如图,下列有关说法不正确的是
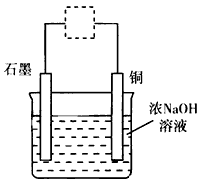
[? ]
A.该实验符合绿色化学的设计理念
B.图中的虚线框内需连接直流电源,且正极与石墨相连
C.CuO高温加热分解也可以得到Cu2O
D.上述装置中,阳极的电极反应式是2Cu+2OH-→Cu2O+H2O+2e-
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列有关电化学的图示,完全正确的是
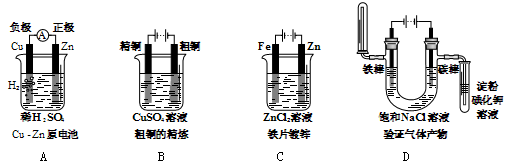
参考答案:D
本题解析:A.是原电池。由于金属活动性Zn>Cu,所以Zn作负极,Cu作正极。在正极上发生还原反应产生氢气,电极判断不对,错误;B.在铜的精炼中,精铜作阴极,粗铜作阳极,含有Cu2+的盐溶液如CuSO4溶液作电解质溶液,铜的连接不对,错误;C.该装置是电镀,在铁片上镀锌,应该把镀件Fe片作阴极,把Zn片作阳极,含有Zn2+的溶液作电镀溶液,金属片与电源的连接不对,错误;D.电解饱和NaCl溶液,在阳极发生反应:Cl--2e-=Cl2↑,Cl2有氧化性,会把KI中的I-氧化为I2,于淀粉溶液变为蓝色,在阴极发生反应:2H++2e-=H2↑,H2的密度比空气小,用向下排空气的方法收集。由于H+放电,破坏了水的电离平衡,水继续电离,最终当达到平衡时,附近的溶液c(OH-)>c(H+),溶液显碱性,
考点:考查原电池、电解池的反应原理及应用的知识。
本题难度:一般
5、填空题 如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
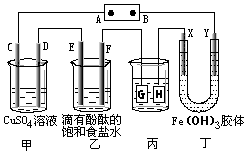
请回答:
(1)B极是电源的___________ ,一段时间后,甲中溶液颜色 __________,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明___________ ,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 ______________。
(3)现用丙装置给铜件镀银,则H应该是______________ (填“镀层金属”或“镀件”),电镀液是___________ 溶液。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为_____________ ,甲中溶液的pH _____________(填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是______________ 。
参考答案:(1)负极; 逐渐变浅; 氢氧化铁胶体粒子带正电荷?
(2)1∶2∶2∶2?
(3)镀件; AgNO3; 5.4g ;变小?
(4)Fe + Cu2+ Cu + Fe2+
Cu + Fe2+
本题解析:
本题难度:一般