|
|
|
高考化学必考知识点《反应速率与平衡的有关计算》高频考点强化练习(2017年最新版)(九)
2017-09-23 23:28:26
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)碳及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化SO2被还原为S。
已知: C(s)+ (g)=CO(g)ΔH1=-126.4kJ/mol?① (g)=CO(g)ΔH1=-126.4kJ/mol?①
C(s)+O2(g)=CO2(g)? ΔH2= -393.5kJ·mol-1?②
?S(s)+O2(g)=SO2(g)?ΔH3= -296.8kJ·mol-1?③
则SO2氧化CO的热化学反应方程式:?
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。 CH3OH(g)。
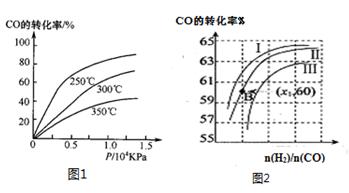
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应ΔH?0(填“>”或“ <”)。
图2表示CO的转化率与起始投料比[ n(H2)/n(CO)]、温度的变化关系,曲线I、II、III对应的平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为?;测得B(X1,60)点氢气的转化率为40%,则x1=?。
②在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是?(填序号)。
A.正反应速率先增大后减小
B.逆反应速率先增大后减小
C.化学平衡常数K值增大
D.反应物的体积百分含量增大
| E. 混合气体的密度增大
③一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K=?。
(3)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。
原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O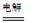 CH3CHOH+CH3CHOOH。 CH3CHOH+CH3CHOOH。
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的?处理过程,其装置示意图如图所示:
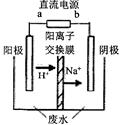
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为:
4OH--4e-═O2↑+2H2O;??。
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入1m3乙醛的含量为300mg/L的废水,可得到乙醇??kg(计算结果保留2位小数)
2、填空题 (14分)在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)  ?2NO2 (g)? △H> 0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化关系如下图所示。 ?2NO2 (g)? △H> 0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化关系如下图所示。
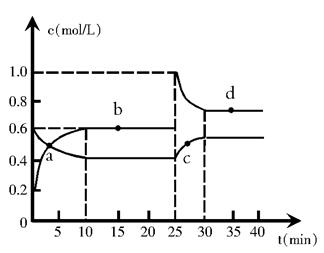
(1)该温度时,该反应的平衡常数为________________, 若温度升高,K值将__________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,化学反应处于平衡状态的是____________点。从起点开始首次达到平衡时,以NO2表示的平均反应速率为______________________。
(3)25 min时,增加了______mol___________(填物质的化学式)使平衡发生了移动。
(4)d点对应NO2的物质的量浓度______(填“>”、“<”或“=”)0.8mol?L-1,理由是_____________________________________________________。
3、填空题 (16分)化工工业中常用乙苯脱氢的方法制备苯乙烯。
(1)已知某温度下:
反应①:CO2(g) +H2 (g)→CO(g)? +? H2O(g),ΔH= +41.2 kJ/mol
反应②: 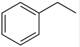 (g)→ (g)→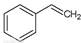 (g)+H2(g),ΔH=" +117.6" kJ/mol (g)+H2(g),ΔH=" +117.6" kJ/mol
②的化学反应平衡常数分别为K1、K2。
请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式?。该反应的化学平衡常数K=?(用K1、K2表示)。
(2)对于反应①,恒温恒容条件下,向密闭容器中加入2molCO2和2molH2,当反应达到平衡后,以下说法正确的是?。
A.因为该反应是吸热反应,所以升高温度,正反应速率增大,逆反应速率减小;
B.若继续加入1molCO2、1mol H2,平衡向正反应方向移动;
C.若继续通入1mol CO2则平衡向正反应方向移动,CO2的转化率增大;
D.压缩体积,平衡不移动,反应物和产物的浓度都不变;
|
(3)温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2;请在下图中画出t1之后的正逆反应曲线,并作出标注。

(4)已知某温度下, Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ksp(Ag2SO4)=
?;(两位有效数字)
(5)电解法制备高铁酸钠(Na2FeO4),总反应式为:Fe+2H2O+2OH- = FeO42-+3H2,电解质溶液选用NaOH溶液。该电解池阳极材料是
??(写化学式) ;阳极的电极反应式为:
?。
4、填空题 高炉炼铁过程中发生的主要反应为1/3Fe2O3(s) + CO(g) ?2/3Fe(s) + CO2(g)
?2/3Fe(s) + CO2(g)
已知该反应在不同温度下的平衡常数如下:

请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min达到平衡。求该时间范围内反应的平均反应速率υ(CO2)=" _________" 、CO的平衡转化率= _____________:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量
B.增加Fe203的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
5、选择题 已建立平衡的可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
①生成物的百分含量一定增加;? ②生成物的产量一定增加;
③反应物的转化率一定增加;? ④反应物物质的量浓度一定减小;
⑤正反应速率一定大于逆反应速率;? ⑥使用了催化剂
A.①②
B.②⑤
C.③⑤
D.③④⑥
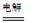 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。

 ?2/3Fe(s) + CO2(g)
?2/3Fe(s) + CO2(g)