微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (5分)元素X、Y、Z、W均为短周期元素,且原子序数依次增大。已知Y原子最外层电子数占核外电子总数的 3/4 ,W-、Z+、X+的离子半径逐渐减小,化合物XW常温下为气体,Z是本周期中除稀有气体元素外,原子半径最大的元素。据此回答下列问题:
(1)W在元素周期表中的位置?,实验室制取W单质的离子方程式是?;
(2)A、B均由上述四种元素中的三种组成的强电解质,A是一种强碱,B是某种家用消毒液的有效成分,则A、B的化学式分别为?、?;
(3)C是由Y和Z两种元素组成的一种化合物,其中Y和Z的原子个数比为1∶1,则C的电子式是?;
参考答案:每空1分,共5分。
(1)第三周期、ⅦA族,
MnO2 + 4H+ + 2Cl- ?Mn2+ + 2H2O + Cl2↑
?Mn2+ + 2H2O + Cl2↑
(2)NaOH 、 NaClO
(3)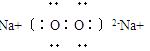
本题解析:略
本题难度:一般
2、选择题 四种短周期元素X、Y、Z、W在元素周期表中的相对位置如下表所示,Y、Z质子数之和为21,下列说法中不正确的是?(?)
?
A.X、Y、Z、W均为非金属元素
B.X、Y、W的氢化物中,Y的氢化物沸点最高
C.Z的阳离子与Y的阴离子电子层结构相同
D.W元素的简单离子半径大于Z元素的简单离子半径
参考答案:
A
本题解析:略
本题难度:一般
3、简答题 氟碳铈矿主要化学成分为CeFCO3,它是提取铈族稀土元素的重要矿物原料.氟碳铈矿的冶炼处理工艺已经发展到十数种,其中一种提取铈的工艺流程如下:
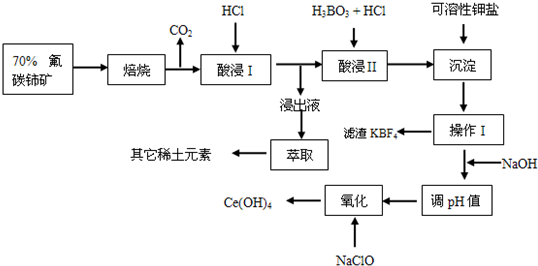
已知:焙烧后烧渣中含+4价的铈及+3价的其它稀土氟氧化物;酸浸I的浸出液中含少量的+3价的铈
请回答下列问题
(1)焙烧前将矿石粉碎成细颗粒的目的是______.
(2)酸浸II后,四价铈转化为三价,为了避免三价铈以四氟硼酸盐形式损失,用可溶性钾盐将四氟硼酸根沉淀除去,该反应的离子方程式为:______
(3)在生产过程中,酸浸I?中会产生大量黄绿色气体,污染环境、腐蚀设备,写出产生黄绿色气体的离子方程式:______,提出一种解决的方案:______.
(4)实验室中进行操作I所用玻璃仪器名称:______;在操作I后的溶液中加入NaOH溶液是为了调节溶液pH值获得Ce(OH)3,测定该溶液pH值的操作是______.
(5)写出氧化步骤的化学方程式:______,其中还原产物是______.
参考答案:(1)对于固体参加的反应来说,固体表面积越大,反应速率越大,故答案为:增大固体与空气的接触面积,增大反应速率;提高原料的利用率;
(2)根据题意可知应为KBF4沉淀,故答案为:K++BF4-=KBF4↓;
(3)在生产过程中,酸浸I中会产生大量黄绿色气体,说明Ce4+离子具有强氧化性,可将Cl-氧化为Cl2,为避免污染环境、腐蚀设备,应用硫酸酸浸,故答案为:2Ce4++2Cl-=2Ce3++Cl2↑;用H2SO4酸浸;
(4)过滤用到的仪器有铁架台、烧杯、漏斗、玻璃棒和滤纸等;实验室测定PH的方法是撕下一小片pH试纸放在干燥洁净的表面皿上,用玻璃棒蘸取该溶液点在pH试纸的中央,然后与标准比色卡对比;故答案为:漏斗、烧杯、玻璃棒;撕下一小片pH试纸放在干燥洁净的表面皿上,用玻璃棒蘸取该溶液点在pH试纸的中央,然后与标准比色卡对比;
(5)NaClO将Ce(OH)3氧化为Ce(OH)4,其中NaCl为还原产物,故答案为:2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl;?
NaCl.
本题解析:
本题难度:一般
4、填空题 甲、乙、丙、丁、戊是五种短周期元素,其原子序数依次增大,它们可以组成下列框图所有物质.甲与乙、丙与乙均可形成原子个数比为2:1和1:1的化合物,丁元素原子的最外层电子数是其电子层数的2倍,框图中溶液M为黄绿色.在一定条件下,下列各物质可发生如图所示的变化.试回答:
(1)戊元素的原子结构示意图为______
(2)A的电子式为______
(3)工业上由F制备H的条件是______
(4)反应(Ⅰ)的离子方程式为______.
(5)反应(Ⅱ)的化学方程式为______.
参考答案:甲与乙、丙与乙均可形成原子个数比为2:1和1:1的化合物,常见化合物有H2O、H2O2、Na2O、Na2O2等,则甲为H,乙为O,丙为Na,丁元素原子的最外层电子数是其电子层数的2倍,且原子序数大于丙,则应为S,溶液M为黄绿色,应为氯气的水溶液,说明戊应为Cl元素,气体F与M反应生成两种溶液,其中M为氯气,应为SO2和Cl2的反应,生成H2SO4和HCl,则F为SO2,与O2反应最终生成硫酸,则D为O2,H为SO3,E为H2SO4,L为HCl,K应为H2O,固体A与水反应生成O2,应为Na2O2,与水反应还生成NaOH,即C为NaOH,与少量SO2反应生成Na2SO3,固体B应为Na2SO3,G为Na2SO4,则
(1)戊为Cl元素,原子核外有3个电子层,最外层电子数为7,原子结构示意图为
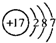
,故答案为:
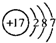
;
(2)A为Na2O2,为离子化合物,电子式为
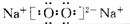
,故答案为:
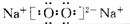
;
(3)工业由SO2制备SO3,在常压下、500℃以及为催化剂的条件下反应,
故答案为:常压、催化剂(或V2O5)、500℃左右(高温);
(4)C为NaOH,与少量SO2反应生成Na2SO3,反应的离子方程式为2OH-+SO2═SO32-+H2O,
故答案为:2OH-+SO2═SO32-+H2O;
(5)SO2和Cl2的反应,生成H2SO4和HCl,反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl.
本题解析:
本题难度:简单
5、填空题 (15分)A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):
A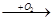 B
B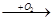 C
C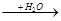 D
D
(1)若A、D的水溶液均能使湿润的蓝色石蕊试纸变红,则A、D分别为(填写化学式)。
A ?,D?。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红,则A为?。写出A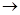 B转化的化学方程式:?。
B转化的化学方程式:?。
(3)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,则A是??,
B是?,C是?。C可作为呼吸面具的填充剂,C与二氧化碳发生反应的化学方程式为:?。A跟水发生反应的化学方程式??。
(4)若A为常见的非金属单质,则A有多种情况,请填写下表,并完成相应的化学反应方程式。(可以不填满,也可以补充)