微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (10分)某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
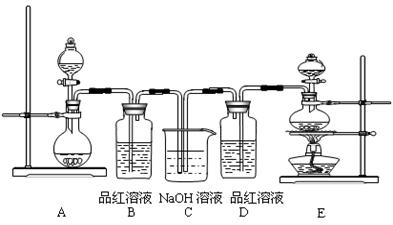
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质______、_______。?
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:B ?, D_________________。
(3)装置C的作用是________________________________。
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
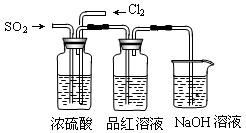
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。
试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是:?
?。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
?
参考答案:(10分)(1)酸性(1分)、还原性(1分);
(2)B溶液恢复红色(1分),? D溶液仍无色(1分)
(3)吸收多余的SO2和Cl2,防止污染环境(2分)
(4)①控制SO2和Cl2按物质的量之比1︰1进气,二者发生反应,生成无漂白性的H2SO4和HCl,SO2 + Cl2 + 2H2O =SO42-+ 2Cl—+ 4H+ (2分)
②控制SO2和Cl2进气的物质的量,使之不相等(2分)
本题解析:略
本题难度:一般
2、实验题 在呼吸面具和潜水艇中可以用过氧化钠作为供氧剂。某化学探究学习小组选用适当的化学试剂和实验用品,用下图中实验装置,进行实验来证明过氧化钠可作供氧剂。其中,A是实验室制取CO2的装置,D中装有过氧化钠固体。

(1)写出A装置中发生反应的离子方程式:?;
(2)填写表中空格:
仪器
| 加入试剂
| 加入该试剂的目的
|
B
| 饱和NaHCO3溶液
| ?
|
C
| ?
| 除去CO2中的水蒸气
|
E
| ?
| ?
|
(3)若无C装置,对实现该实验目的是否有影响?(填“是”或“否”),
原因????;
(4)试管F中收集满气体并从水中取出后,下一步实验操作为:?。
参考答案:(1)CaCO3+2H+=Ca2++H2O+CO2↑?(2分)
(2)(每空1分)
仪器
加入试剂
加入该试剂的目的
B
?
除去CO2中的HCl
C
浓硫酸
?
E
NaOH溶液
除去O2中的CO2
(3)否(1分),2Na2O2+2H2O=4NaOH+O2?(2分)
(4)立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气。?(2分)
本题解析:(1)A是实验室制取CO2的装置,所以发生反应的离子方程式是CaCO3+2H+=Ca2++H2O+CO2↑。
(2)由于生成的CO2中含有水蒸气和氯化氢气体,所以再和过氧化钠反应之前,需要除杂。B中饱和碳酸氢钠溶液除去的杂质是氯化氢;C中的试剂原来构造CO2,则选择的是浓硫酸;由于生成的氧气中含有未反应的CO2,因此为了防止CO2对氧气收集的干扰,需要先除去CO2,则E中氢氧化钠溶液的作用就是除去氧气中的CO2气体。
(4)由于水蒸气也能和过氧化钠反应生成氧气,因此也可以证明过氧化钠可作供氧剂,所以若无C装置,对实现该实验目的无影响。
(4)试管F中收集满气体并从水中取出后,下一步实验操作应该是检验收集的气体是否是氧气,正确的做法是立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气。2的制备、除杂,过氧化钠做供氧剂的有关判断、氧气的检验
点评:该题是中等难度的试题,试题注重基础,侧重实验能力的培养和训练,有利于培养学生严谨的实验设计和动手操作能力,提高学生的综合实验能力。该题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
3、实验题 某化学实验兴趣小组在“探究氯水与溴化亚铁溶液反应”的实验中发现:“在足量的溴化亚铁溶液中,加入1~2滴氯水,振荡后溶液呈黄色。”
【资料】
| 溴水是溴单质的水溶液,因溶有溴单质而呈黄色。
|
根据已有化学知识及资料,请你参与上述现象形成原因的分析与探究:
(1)提出问题猜想:
溶液呈黄色是因发生离子反应①?(填离子方程式)所致。
溶液呈黄色是因发生离子反应②?(填离子方程式)所致。
(2)设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验。请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
试剂
| 酚酞试液、CCl4、无水酒精、KSCN溶液
|
方案
| 操作步骤
| 实验现象
| 结论
|
1
| 取所述黄色溶液于试管中,滴加?并振荡
| 溶液变红色
| 反应?所致
|
2
| 取所述黄色溶液于试管中,滴加?并振荡
| ________
________
|
(3)实验结论:以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br-?(填“强”或“弱”)。
(4)实验反思
I. 根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是?。
Ⅱ. 在100 mLFeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为?。
参考答案:(1)2Fe2++Cl2=2Fe3++2Cl-;2Br-+Cl2=Br2+2Cl-
(2)
方案
操作步骤
实验现象
结论
1
KSCN溶液
?
①
2
CCl4
溶液分上下两层,上层为黄色、下层为无色
本题解析:(1)因为单质溴和铁离子在溶液中均显黄色,氯气既能氧化亚铁离子生成铁离子,还能氧化溴离子生成单质溴。所以反应的离子方程式分别为2Fe2++Cl2=2Fe3++2Cl-、2Br-+Cl2=Br2+2Cl-。
(2)如果反应中生成铁离子,则加入KSCN溶液,溶液应该显红色。如果生成的是单质溴,则可以利用萃取进行验证。
(3)亚铁离子的还原性强于溴离子的,所以氯气首先氧化的是亚铁离子。
(4)如果氯水足量,则溴离子也被氧化生成单质溴。如果加入CCl4并充分振荡后静止,溶液应分上下两层,上层为黄色、下层为橙红色。如果FeBr2的物质的量是xmol,则根据得失电子守恒可知x×1+2x×1/2×1=0.1×2,解得x=0.1,所以浓度是1mol/L。
本题难度:一般
4、实验题 Fe2O3、Cu2O都是红色粉末,常用作颜料。某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO。
提出假设:?
假设1:红色粉末是Fe2O3?
假设2:红色粉末是Cu2O
(1)假设3:?
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 溶液。
(2)若假设1成立,则实验现象是?。
(3)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗??。
简述你的理由?。
(4)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是?,写出发生反应的离子方程式?、?、?。
探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(5) 实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为?。
参考答案:(1)假设3:红色粉末是Fe2O3和Cu2O的混合物(1分)
(2)溶液变为血红色(1分)
(3)不合理? Cu能将Fe3+还原为Fe2+(2分)
(4)Fe2O3和Cu2O的混合物?
Fe2O3+6H+ = 2Fe3++3H2O? Cu2O+2H+ =" Cu" + Cu2+ + H2O
2 Fe3+ + Cu =" 2" Fe2+ + Cu2+(每个1分,共4分)
(5)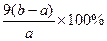 (1分)
(1分)
本题解析:略
本题难度:一般
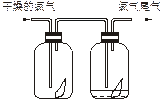
5、选择题 (1)如下图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是________________。
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_____________溶液吸收多余的氯气,原理是(用化学方程式表示)__________________________。
根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是___________(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是___________(用字母代号填)。
A.O2? B.Cl2? C.CO2? D.HClO
(3)据“北方网”报道,2004年4月15日至16日,位于重庆市江北区的天原化工总厂相继发生氯气泄漏和爆炸事故。截至记者发稿时,已有9人在事故中失踪死亡,3人受伤,15万人被紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是_______。
A.NaOH? B.NaCl? C.KBr? D.Na2CO3
参考答案:(1)潮湿的有色布条褪色而干燥有色布条不褪色?(2)氢氧化钠(NaOH)? 2NaOH+Cl2====NaClO+NaCl+H2O? Ca(ClO)2? C?(3)D
本题解析:略
本题难度:一般