微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某校研究性学习小组设计了如下实验步骤来提取碘:
①加H2O2②将海带烧成灰,向灰中加水搅拌③加CC14振荡④过滤⑤用分液漏斗分液。合理的操作顺序为?
A.②→④→①→③→⑤
B.②→①→③→④→⑤
C.③→①→②→⑤→④
D.①→③→⑤→②→④
参考答案:A
本题解析:要提取碘,则应该用氧化剂把碘离子氧化生成单质碘,然后利用碘单质易溶在有机溶剂中,通过萃取即可,答案选A。
本题难度:简单
2、实验题 (9分)同学们已经学习了几种典型的有机化学反应类型——取代反应、加成反应、酯化反应,写出下列反应的化学反应方程式,并判断其反应类型。
(1)由乙烯制氯乙烷:____________________________,属于______________反应。
(2)由苯制取硝基苯:____________________________,属于______________反应。
(3)由苯制取环己烷:____________________________,属于______________反应。
参考答案:(1)C2H4+HCl→C2H5Cl?加成
(2)C6H6+HNO3→C6H5NO2+H2O?取代
(3)C6H6+3H2→C6H12?加成
本题解析:取代、加成、酯化是有机化学中三个重要的反应类型。学习时抓住反应的本质,特别是官能团的变化,方程式就会顺利写出。
本题难度:简单
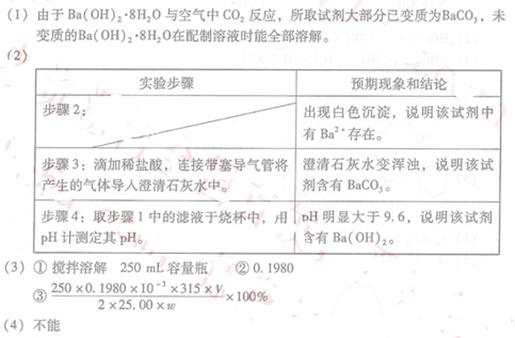
3、实验题 某同学进行实验研究时,欲配制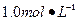 Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
(1)烧杯中未溶物仅为BaCO3,理由是?
(2)假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计实验方案,进行成分检验。在答题卡上写出实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管

(3)将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量。实验如下:
①配制250ml 约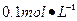 Ba(OH)2·8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,?,将溶液转入?,洗涤,定容,摇匀。
Ba(OH)2·8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,?,将溶液转入?,洗涤,定容,摇匀。
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将 ??(填“0.020”、“0.05”、“0.1980”或“1.5”)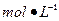 盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。
盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。
③ 计算Ba(OH)2·8H2O的质量分数=?(只列出算式,不做运算)
(4)室温下,?(填“能”或“不能”) 配制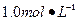 Ba(OH)2溶液。
Ba(OH)2溶液。
参考答案:
本题解析:略
本题难度:一般
4、选择题 有机物的天然提取和人工合成往往得到的是混合物,假设给你一种这样的有机混合物让你研究,一般要采取的几个步骤是
[? ]
A.分离、提纯→确定化学式→确定实验式→确定结构式
B.分离、提纯→确定实验式→确定化学式→确定结构式
C.分离、提纯→确定结构式→确定实验式→确定化学式
D.确定化学式→确定实验式→确定结构式→分离、提纯
参考答案:B
本题解析:
本题难度:一般
5、填空题 用实验确定某酸HB的弱电解质.两同学的方案是:
甲:
①称取一定质量的HB配制0.1mol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HB是弱电解质.
乙:
①用已知物质的量浓度的HB溶液、盐酸,分别配制pH=1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HB是弱电解质.
(1)在两个方案的第①步中,都要用到的定量仪器是______.
(2)甲方案中,说明HB是弱电解质的理由是测得溶液的pH______1(选填>、<、=)乙方案中,说明HB是弱电解质的现象是______(多选扣分).
A.HCl溶液的试管中放出H2的速率快;
B.装HB溶液的试管中放出H2的速率快;
C.两个试管中产生气体速率一样快.
(3)请你评价:乙方案中两个难以实现之处______.
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表达.______.
参考答案:(1)在两个方案的第①步中,配制0.1mol/L的溶液100mL、配制pH=1的两种酸溶液各100mL,配制一定浓度的溶液知必须使用容量瓶,
故答案为:100mL的容量瓶;
(2)弱酸在水溶液里部分电离,所以氢离子浓度小于酸浓度,如果该酸是弱酸,则0.1mol/L的HA溶液的pH>1;pH相等的一元酸,弱酸的浓度大于强酸,等体积等PH的醋酸和盐酸稀释相同倍数时,醋酸中氢离子浓度大于盐酸,分别和锌反应时,弱酸生成氢气的反应速率大于强酸,故B正确,
故答案为:>;B;
(3)HA是弱酸存在电离平衡,所以配制pH=1的HA溶液难以实现,反应物的接触面积与反应速率成正比,锌粒的表面积大小难以控制,所以实现较困难,
故答案为:配制pH=1的HA溶液难以实现,加入锌粒难以做到表面积相同;
(4)可以通过测定NaB溶液的pH大小,判断HB为弱电解质,方法为:配制NaB溶液,测定溶液的pH>7,证明HB为弱电解质,
故答案为:配制NaB溶液,测定溶液的pH>7,证明HB为弱电解质.
本题解析:
本题难度:一般