微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知反应:①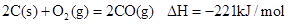 ②稀溶液中,
②稀溶液中,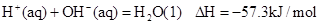 ,下列结论正确的是:
,下列结论正确的是:
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为△H=57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量
参考答案:A
本题解析:A、燃烧热为1mol物质完全燃烧放出的热量,1molC不完全燃烧,放出110.5KJ,完全燃烧大于110.5KJ;
B、反应热为-221KJ/mol;
C、中和热放热,故△H=-57.3kJ/mol;
D、醋酸电离吸热,故放出的热量小于57.3kJ
本题难度:简单
2、选择题 断裂下列化学键需要吸收的能量分别为:H-H:436 kJ/mol F-F:153 kJ/mol H-F:565 kJ/mol,下列说法正确的是( )
A.H2与F2反应的热化学方程式为:
H2(g)+F2(g)=2HF(g) ΔH=-541 kJ
B.2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量
C.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于541 kJ
D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
参考答案:D
本题解析:焓变ΔH的单位是kJ/mol,A项错误;依据题目提供的键能数据,可知应是
2 mol HF气体分解成1 mol H2和1 mol F2时吸收541 kJ的热量,B项错误;气态HF变为液态时要放出热量,所以1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量大于541 kJ,C项错误;H2与F2的反应是放热反应,说明在相同条件下,反应物的总能量大于生成物的总能量,D项正确。
本题难度:一般
3、选择题 下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ·mol-1
B.由N2(g)+3H2(g) 2NH3(g)△H=-92.4 kJ·mol-1热化学方程式可知, 当反应中转移6NA电子时,反应放出的热小于92.4 kJ
2NH3(g)△H=-92.4 kJ·mol-1热化学方程式可知, 当反应中转移6NA电子时,反应放出的热小于92.4 kJ
C.HCl和NaOH反应的中和热△H="-57.3" kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
D.在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ·mol-1
参考答案:D
本题解析:A、甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)?△H=-890.3 kJ·mol-1,错误;B、反应放出的热等于92.4 kJ,错误;C、有CaSO4沉淀生成,错误。
本题难度:一般
4、填空题 ?(附加题1)用1 L 1.0 mol/LNaOH溶液吸收35.2 g CO2气体,溶液中CO32-与HCO3-的物质的量之比为1∶3;反应的化学方程式为_______________________________________。
参考答案:5NaOH + 4CO2=? 3NaHCO3?+? Na2CO3 + H2O
本题解析:35.2 g CO2气体是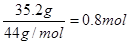 ,氢氧化钠是1.0mol
,氢氧化钠是1.0mol
即二者的物质的量之比是4︰5,而溶液中CO32-与HCO3-的物质的量之比为1∶3
所以方程式为5NaOH + 4CO2=? 3NaHCO3?+? Na2CO3 + H2O。
本题难度:简单
5、填空题 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式?;
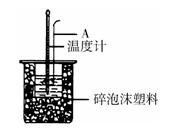
(2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H?(填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和NaOH溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18×10-3? kJ/(g·℃)。为了计算中和热,某学生实验记录数据如下:
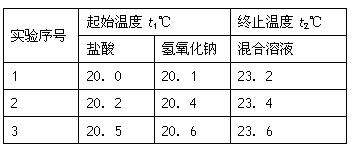 ?
?
依据该学生的实验数据计算,该实验测得的中和热△H=___________;(结果保留一位小数)
(4)若用0.50mol/L醋酸代替盐酸和氢氧化钠溶液反应则测得中和热会?(填“偏大”、“偏小”或“无影响”)。
参考答案:(1)1/2H2SO4(aq)+ NaOH (aq)="=" 1/2Na2SO4(aq)+H2O(1);△H=-57.3kJ·mol-1(2分)
(2)环形玻璃搅拌棒(1分)偏大(1分)
(3)-51.8 kJ/mol(2分)
(4)偏小(1分)
本题解析:略
本题难度:一般