微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列变化中,必须加入氧化剂才能发生的是(?)
A.SO2→S
B.SO32—→SO2
C.HCO3—→CO32—
D.Cl—→Cl2
参考答案:D
本题解析:加入氧化剂才能发生说明原物质是还原剂,也就是化合价升高的变化,A项化合价降低,B项化合价不变,C项化合价没有变化;D项化合价升高;故选D。
点评:属于简单题。
本题难度:一般
2、选择题 下列有关化学用语使用正确的是
A.乙酸、葡萄糖、淀粉的最简式均为CH2O
B.醛基的电子式: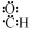
C.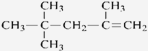 的名称为:2,4,4-三甲基-1-戊烯
的名称为:2,4,4-三甲基-1-戊烯
D.乙醇分子比例模型: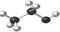
参考答案:C
本题解析:略
本题难度:简单
3、简答题 (1)分子中含有16个共价键的烷烃的分子式是______,1mol该烷烃与氯气发生取代反应,当烷烃中的氢全部被取代后,消耗氯气的物质的量是______mol.
(2)标准状况下11.2L乙烯和乙烷的混合气体通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液的质量增加了5.6g.则原混合气体中乙烯与乙烷的物质的量之比为______.
参考答案:(1)设烷烃的分子式为CnH2n+2,其中含有的C-C共价键数目为n-1,C-H数目为2n+2,则n-1+2n+2=16,n=5,
所以烷烃的分子式为C5H12,1mol该烷烃与氯气发生取代反应,每取代1molH原子,要消耗1mol氯气,
当烷烃中的氢全部被取代后,消耗氯气的物质的量等于1mol烷烃中的物质的量,即12mol,
故答案为:C5H12;12;
(2)乙烯与溴发生加成反应,溴的四氯化碳溶液的质量增加了5.6g,
则:m(C2H4)=5.6g,
n(C2H4)=5.6g28g/mol=0.2mol,
又n(C2H4)+n(C2H6)=11.2L22.4L/mol=0.5mol,
则n(C2H6)=0.5mol-0.2mol=0.2mol,
n(C2H4):n(C2H6)=2:3,
故答案为:2:3.
本题解析:
本题难度:一般
4、填空题 写出下列化学反应的方程式.
(1)写出乙烯和溴水发生反应的化学方程式______.
(2)氧化铝跟氢氧化钠溶液的反应(写离子反应方程式)______.
参考答案:(1)乙烯和溴水发生反应的化学方程式为:CH2=CH2+Br2→CH2Br-CH2Br;故答案为:CH2=CH2+Br2→CH2Br-CH2Br;
(2)氧化铝跟氢氧化钠溶液的反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;故答案为:Al2O3+2OH-=2AlO2-+H2O;
本题解析:
本题难度:一般
5、简答题 已知X是一种酸式盐,H是常见金属单质,F、I是常见非金属单质,D为淡黄色固体,E、G都是工业上重要的碱性物质,A物质可做耐火材料.它们有如图所示的转化关系.
试回答下列问题
(1)X的化学式为:______;G的电子式为______.
(2)写出下列反应的化学方程式
①______?②______.
(3)H与同周期原子序数比其大一的另一种金属组成原电池,H作正极,则负极反应式为______,电解质溶液为______.
(4)H的工业制法可用电解原理,当阳极产生可使湿润的淀粉KI试纸变蓝的气体1.12升(标况)时,阴极生成H______克,有关化学方程式为______.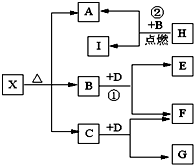
参考答案:H是常见金属单质,I是常见非金属单质,根据关系图,可知H+B=A+I,此为点燃条件下置换反应,且为金属置换非金属,A物质可做耐火材料,初步确定为2Mg+CO2=2MgO+C,H为Mg,B为CO2,I为C,所以A为MgO,A由X分解得到,且X为酸式盐,应为碳酸氢镁,B是CO2,C为H2O,二者均能和D反应,D为淡黄色固体,且都生成F,F是常见非金属单质,可知D为过氧化钠,F为氧气.根据关系图,可知E为碳酸钠,G为氢氧化钠.进行验证符合.
故A为MgO,B是CO2,C为H2O,D为过氧化钠,E为碳酸钠,F为氧气,G为氢氧化钠,H为Mg,I为C.
(1)X为碳酸氢镁,化学式为Mg(HCO3)2;G为氢氧化钠,由钠离子与氢氧根离子构成,电子式为
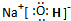
.
故答案为:Mg(HCO3)2;
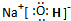
.
(2)①二氧化碳与过氧化钠反应生成碳酸钠与氧气,反应方程式为2Na2O2+2CO2=2Na2CO3+O2.
故答案为:2Na2O2+2CO2=2Na2CO3+O2 .
?②水与过氧化钠反应生成氢氧化钠与氢气,反应方程式为2Na2O2+2H2O═4NaOH+O2↑.
故答案为:2Na2O2+2H2O═4NaOH+O2↑.
(3)H为Mg,Mg与Al组成原电池,Mg作正极,则电解质溶液与Al反应,不与Mg反应,电解质溶液为强碱如NaOH溶液,Al为负极,则负极反应式为Al+4OH--3e-=AlO2-+2H2O.
故答案为:Al+4OH--3e-=AlO2-+2H2O;NaOH溶液.
(4)工业上利用电解熔融的氯化镁生成镁,电解总反应式为MgCl2(熔融)?电解?.?Mg+Cl2↑,阳极产生的氯气为1.12L22.4L/mol=0.05mol,由电解总反应式可知,生成Mg0.05mol,所以生成Mg的质量为0.05mol×24g/mol=1.2g.
故答案为:1.2;MgCl2(熔融)?电解?.?Mg+Cl2↑.
本题解析:
本题难度:一般