微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)已知离子反应: +6I—+6H+=R—+3I2+3H2O,n=_____,R元素在
+6I—+6H+=R—+3I2+3H2O,n=_____,R元素在 中的化合价是_____。
中的化合价是_____。
参考答案:__1_?_, _? +5 __
本题解析:略
本题难度:一般
2、填空题 (3分)试用化合价升降法配平下列化学方程式。
H2SO4+ H2S —— SO2 + S + H2O
参考答案:1、1、1、1、2
本题解析:硫酸中S的化合价是+6价,H2S中S的个÷化合价是-2价,所以硫酸是氧化剂,硫化氢是还原剂。因为同一种元素之间发生氧化还原反应,生成物的化合价只能处于中间,而不能发生交叉,所以SO2是还原产物,单质S是氧化产物,即1mol硫酸得到2mol电子,1mol硫化氢失去2mol电子,所以方程式为H2SO4+H2S=SO2+S+2H2O。
本题难度:一般
3、简答题 本题涉及4种组成不同的配合物,它们都是平面正方形结构。
⑴ PtCl2·2KCl的水溶液与二乙硫醚(Et2S)反应(摩尔比1︰2)得到两种结构不同的黄色配合物,该反应的化学方程式和配合物的立体结构是:
⑵ PtCl2·2KCl的水溶液与足量Et2S反应获得的配合物为淡红色晶体,它与AgNO3反应(摩尔比1︰2)得到两种组成不同的配合物,写出上述两个反应的化学方程式。
参考答案:⑴ PtCl2·2KCl+2Et2S=[Pt(Et2S)2 Cl2]+2KCl(2分)

顺式?反式?(各0.5分)
⑵ 2PtCl2·2KCl+4Et2S=[Pt(Et2S)4][PtCl4]+4KCl(3分)
[Pt(Et2S)4][PtCl4]+2AgNO3=Ag2[PtCl4]+[Pt(Et2S)4](NO3)2(2分)
本题解析:⑴PtCl2·2KCl在水溶液中以K2PtCl4的形式存在,根据题意,与Et2S发生配体的取代反应,生成顺式和反式的Pt(Et2S)2 Cl2。
⑵AgNO3以2∶1的物质的量之比与淡红色晶体反应生成两种不同的配合物,其中一种阳离子为Ag+,阴离子为负二价的PtCl42-,即Ag2[PtCl4]。另外一种配合物(题目中生成了两种配合物)只能为[Pt(Et2S)4](NO3)2,其中配阳离子是可以看成是K2PtCl4与Et2S按1∶4的比例发生配体的取代反应后生成的。因此淡红色晶体为[Pt(Et2S)4][PtCl4]。
本题难度:一般
4、选择题 a mol Cu与含b mol HNO3的溶液恰好完全反应,被还原的HNO3的物质的量一定是
A.(b-2a)mol
B.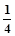 b mol
b mol
C. a mol
a mol
D.2a mol
参考答案:A
本题解析:不管硝酸的浓度如何,由铜的守恒可知,铜均被氧化为a molCu(NO3)2,而硝酸的其它部分被还原,由氮原子的守恒可知,被还原的HNO3的物质的量一定是(b-2a)mol
本题难度:一般
5、简答题 Fe3P与稀HNO3反应生成Fe(NO3)3、NO、H3PO4和H2O。
(1) 写出反应的化学方程式:_______________________________________;
(2) 上述反应中,当生成1.8 mol Fe3+时,放出NO的体积(标准状况下)是__________L,消耗的HNO3是__________mol;
(3) 上述反应中,当有21 mol电子发生转移时,生成H3PO4是_________mol,被还原的HNO3是___________g。
参考答案:(1) 3Fe3P+41HNO3(稀)=9Fe(N03)3+14NO↑+3H3PO4+16H2O;
(2) 62..72;8.2;? (3)1.5;441
本题解析:(1)根据反应物和生成物可知,Fe3P失去14个电子。硝酸当还原产物是NO,硝酸得到3个电子,所以氧化剂和还原剂的物质的量之比是14︰3,因此反应式为3Fe3P+41HNO3(稀)=9Fe(N03)3+14NO↑+3H3PO4+16H2O。
(2)根据方程式可知,当生成1.8 mol Fe3+时,生成NO是 ,其标准状况下的体积是2.8mol×22.4L/mol=62.72L。消耗硝酸是
,其标准状况下的体积是2.8mol×22.4L/mol=62.72L。消耗硝酸是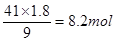 。
。
(3)根据方程式可知,当转移42mol电子时,生成磷酸时3mol,所以当有21 mol电子发生转移时,生成H3PO4是1.5mol。被还原的硝酸是7mol,质量是7mol×63g/mol=441g。
本题难度:一般