微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:

(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~5.0,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是________________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,起目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③_______________________ 。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.0500 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
①上述测定过程中需用溶液润洗的仪器有____________________ 。
②计算上述样品中CaCl2·2H2O的质量分数为________________ 。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有______________;______________________ 。
参考答案:(1)取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3沉淀完全
(2)防止溶液吸收空气中的CO2
(3)①酸式滴定管;②99.9%; ③样品中存在少量的NaCl ;少量CaCl2·2H2O失水
本题解析:
本题难度:一般
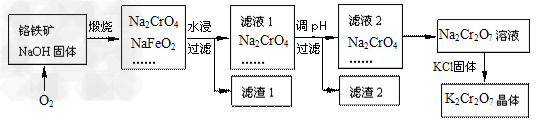
2、填空题 铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:①?NaFeO2遇水强烈水解。?②2CrO42-?+?2H+?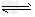 Cr2O72-+?H2O ?
Cr2O72-+?H2O ?
请回答:?
(1)K2Cr2O7中Cr元素的化合价是________________。
(2)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是_____________________。
(3)滤渣1为红褐色的固体,滤渣1的成分是(填名称)______________,滤液1的成分除Na2CrO4、NaOH外,还含有(填化学式)______________。
(4)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,电解时阴极的电极反应式为____________________。
(5)写出由滤液2转化为Na2Cr2O7溶液应采取的措施是___________________。
(6)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、
_________、过滤、洗涤、干燥。
参考答案:(1)+6?
(2)4FeO·Cr2O3 + 7O2 + 20NaOH 8Na2CrO4 + 4NaFeO2+ 10H2O
8Na2CrO4 + 4NaFeO2+ 10H2O
(3)氢氧化铁;NaAlO2、Na2SiO3
(4)Al3++3e-=Al
(5)加稀硫酸酸化
(6)冷却结晶
本题解析:
本题难度:一般
3、填空题 三氯化铁在印刷、照像、医药、颜料以及有机合成催化剂方面有重要的应用。三氯化铁易潮解,在100℃时发生升华。通常,工业生产氯化铁有多种方法;其中一种常温氯化法是将氯气直接通入浸泡铁屑的水中来生成FeCl3。
请回答下列问题: ?
(1)完成常温氯化法制氯化铁过程中的化学反应方程式_____________(至少写出两个反应)。 ?
(2)现对制备氯化铁的工艺进行改进,以废铁屑(含有SiO2、Al2O3、MgO、Fe2O3等杂质)为原料。其生产流程如图:?

已知:氢氧化物沉淀过程中的pH:?
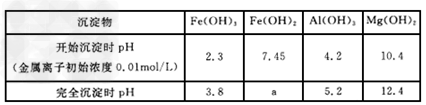
KSPFe(OH)2=1×10-15
①X最好加入_________,写出相应的离子反应方程式_______________
A.KMnO4? B.FeCl3? C.H2O2? D.HNO3
②加入试剂Y的目的是调节pH的范围,试剂Y是____________。上表中a=__________。?
(3)改进后的方法与前一种方法比较优点是_______________。 ?
(4)实验室可以用下图所示装置制取无水三氯化铁。在实验开始时,A、B两个酒精应先点燃一会儿的是____________(填A或B),该装置应如何改进__________。

参考答案:(1)①?Cl2+H2O=HCl+HClO?;②2HCl+Fe=FeCl2+H2↑?; ③2FeCl2+HClO+HCl=2FeCl3+H2O?(2FeCl2+Cl2=2FeCl3?也可)
(2)①C ;?H2O2+2Fe2+ +2H+=2Fe3+ +2H2O ;②Fe2O3?或Fe(OH)3? ;?9
(3)①过程中没有使用有毒的Cl2 ,绿色环保
②反应条件温和
③原料常见低廉
(4)A? ;干燥管末端增加尾气处理装置
本题解析:
本题难度:一般
4、填空题 硫酸铁铵 [a(NH4)2SO4·bFe2(SO4)3·cH2O] 常作为高铁的标准,可用于测定卤素的指示剂。某工厂实验室用一种硫酸亚铁样品(含少量硝酸钙)和硫酸铵为原料,设计如下工艺过程,制取硫酸铁铵:

请完成下列填空:
(1)写出A、B适宜的化学式:A? 、B? 。
(2)减压过滤得到的滤渣C,其主要成分是? (填化学式)。操作甲的目的是:? 。
(3)操作乙、丙的名称分别是:乙? ,丙? 。
(4)检验产品硫酸铁铵中的阳离子,相关的离子方程式有? 。
(5)为了用重量法确定产品硫酸铁铵[a(NH4)2SO4·bFe2(SO4)3·cH2O]中a、b、c的值(供选用的试剂:浓硫酸、碱石灰、氢氧化钠、氯化钡),除了测得取用样品的质量外,至少还需要测定? 。灼烧固体所需要的仪器是______________(选出合适的选项)
?A.坩埚 B.滤纸 C.酒精喷灯 D.玻璃棒
参考答案:(1) H2SO4 ;H2O2?
(2)CaSO4;检验Fe2+是否已全部被氧化。
(3)冷却结晶;常温晾干?
(4) NH4++OH- NH3↑+H2O 、 Fe3++3SCN-
NH3↑+H2O 、 Fe3++3SCN- Fe(SCN)3?
Fe(SCN)3?
(5) 2; 蒸发皿、玻棒、酒精灯
本题解析:
本题难度:一般
5、填空题 二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下
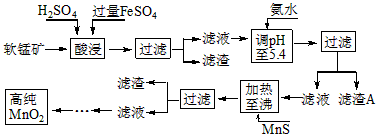
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题

(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为
_________________________。
(2)滤渣A的主要成分是_____________________________。
(3)加入MnS的目的是除去______________________杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为___________________________。
(5)从废旧碱性锌锰电池中可以回收利用的物质有____________________________(写两种)。
参考答案:(1)MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O
(2)Fe(OH)3、Al(OH)3
(3)Cu2+、Zn2+
(4)MnO2+H2O+e-=MnO(OH)+OH-(或2MnO2+H2O+2e-=Mn2O3+2OH-)
(5)锌、二氧化锰
本题解析:
本题难度:一般