微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制 备高纯硅的主要方法,生产过程示意图如下:

①写出由纯SiHCl3,制备高纯硅的化学反应方程式________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式______________________________;H2还原SiHCl3 过程中若混入O2,可能引起的后果是_________________________________。
(2)下列有关硅材料的说法正确的是____(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料--光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅?
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释________。
参考答案:(1)①SiHCl3+H2 Si+3HCl;②SiHCl3+3H2O= H2SiO3↓十3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸,氧气可能会氧化SiHCl3,
Si+3HCl;②SiHCl3+3H2O= H2SiO3↓十3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸,氧气可能会氧化SiHCl3,
(2)BC
(3)现象:试管中有白色胶状沉淀生成,并且有刺激性气体生成。
本题解析:
本题难度:一般
2、填空题 (三选一)【化学与技术】
聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结 晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:

(1)搅拌加热操作过程中发生反应的离子方程式为:__________;_____________。
(2)生产过程中B和D的操作名称分别是_________和_________(B和D均为简单操作)。
(3)反应中副产品a是_________________。
(4)生产过程中可循环使用的物质是_____________(用化学式表示)。
(5)调节pH至4.0~4.5的目的是_____________。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程C物质可选用__________。
A、NaOH B、Al C、氨水 D、Al2O3
参考答案:(1)Al2O3+6H+=2Al3++3H2O;2Al+6H+=2Al3++3H2↑
(2)过滤;过滤
(3)H2
(4)HCl
(5)促进AlCl3水解,使晶体析出
(6)BD
本题解析:
本题难度:一般
3、填空题 硫酸铜在工农业生产中有着广泛的应用,用某种氧化铜矿制备硫酸铜的工艺流程如下
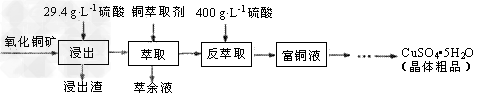
(1)浸出时所用硫酸的质量浓度(单位体积的溶液所含溶质的质量)为29.4g·L-1,其物质的量浓度是_____,浸出过程中反应的化学方程式是___________________。
(2)萃取“相比”是表示萃取效果的参数之一,指的是有机相(O)与水相(A)的体积比。采用一定浓度的铜萃取剂萃取硫酸浸出液中的铜离子,测得当萃取时间为120s时, “相比”(O/A)对铜萃取率的影响如图所示。在实际操作中“相比”应选择_______?。(填序号)
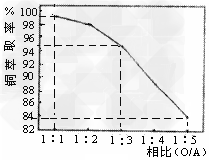
A.1:1?B.1:3?C.1:5
(3)已知铜萃取剂可用HR(O)表示,萃取过程可表示为:Cu2++2HR(O) CuR2(O)+2H+,反萃?取加入400?g/L?硫酸的理由是________________。
CuR2(O)+2H+,反萃?取加入400?g/L?硫酸的理由是________________。
(4)从富铜液中获得较多晶体粗品的实验操作依次是________、________(填操作名称)过滤、干燥。
(5)游泳场馆常用硫酸铜作杀菌剂,这是利用了CuSO4的?_________性质。
参考答案:(1)0.3mol·L-1;?CuO+H2SO4=CuSO4+H2O
(2)B
(3)增大c(H+)使平衡逆向移动,有利于铜离子反萃取(或其它合理答案)
(4)蒸发浓缩;冷却结晶
(5)可使蛋白质变性
本题解析:
本题难度:一般
4、填空题 以废铁屑为原料生产莫尔盐的主要流程如下
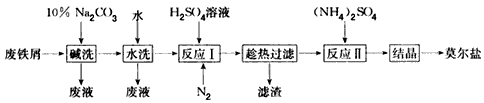
(1)“反应I”中通入N2的作用是____________。
(2)称取23. 52 g新制莫尔盐,溶于水配制成100 mL溶液,将所得溶液分成两等份。
一份加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色石蕊试纸变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;用足量稀盐酸处理沉淀物,充分反应后过滤、洗涤和干燥,得白色固体13. 98 g。
另一份用 0. 200 0 mol/LK2Cr2O7酸性溶液滴定,当CrO72-恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为25. 00 mL。通过计算确定莫尔盐的化学式。
(3)若将“水洗”这一步去掉,则所得产品中的SO42-的质量分数会____________(填 “偏大”“偏小”或“不变”)。
参考答案:(1)防止Fe2+被氧化为Fe3+,且起搅拌作用,以加快反应速率(2)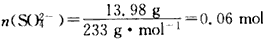
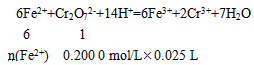 n(Fe2+)=0. 005 mol×6=0. 03 mol
n(Fe2+)=0. 005 mol×6=0. 03 mol
n(NH4+)+2n(Fe2+)=2n(SO42-),n(NH4+)=0. 06 moln(H2O)=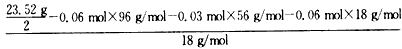 =0.18 moln(SO42-):n(Fe2+):n(NH4+):n(H2O)= 0.06 mol:0.03 mol:0. 06 mol:0.18 mol=2:1:2:6
=0.18 moln(SO42-):n(Fe2+):n(NH4+):n(H2O)= 0.06 mol:0.03 mol:0. 06 mol:0.18 mol=2:1:2:6
奠尔盐的化学式为(NH4)2Fe(SO4)2·6H2O [或(NH4)2SO4·FeSO4·6H2O]
(3)偏小
本题解析:
本题难度:一般
5、填空题 氮氧化铝(AlON)具有优异的物理、化学性质,具备多晶陶瓷在材料制备方面的优势,是优秀的光学窗口材料,有着广阔的应用前景。工业上采用氧化铝的碳热还原氮化反应制得,其有关工艺流程如下
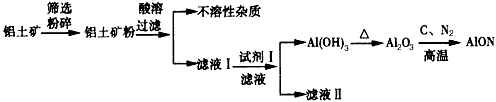
(1)铝土矿粉酸溶时酸不宜过量太多的原因是_________________。
(2)试剂I的化学式为_______,反应的离子方程式为___________________。
(3)写出制备AlON的化学方程式__________________。
(4)滤液Ⅱ的一种重要用途是____________。
参考答案:(1)酸越多,后面消耗的碱就越多
(2)NH3·H2O;Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(3)Al2O3+C+N2 2AlON+CO
2AlON+CO
(4)作化肥
本题解析:
本题难度:一般