| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《离子共存》答题技巧(2017年最新版)(四)
参考答案:B 本题解析:A.碱性溶液中Al3+、H2PO4—不可能大量存在 本题难度:一般 2、选择题 在含有Fe3+、Al3+、H+的溶液中滴加NaOH溶液时,下列关于生成沉淀的质量与滴入NaOH溶液体积的关系,图示中正确的是 参考答案:B 本题解析:含有Fe3+、Al3+、H+的溶液中滴加NaOH溶液时,氢氧化钠先和氢离子反应,所以刚开始一段,没有沉淀;然后铁离子和铝离子都会和氢氧化钠反应生成沉淀,随着氢氧化钠加入过量,氢氧化铝会被反应掉,沉淀的量会减少,最终出现一个平台;故选B。 本题难度:简单 3、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是 |
参考答案:B
本题解析:A、在次氯酸根离子存在的溶液中,次氯酸根离子与SO32-、S2-发生氧化还原反应,不能大量共存,错误;B、由水电离的c(H+)=1×10-12 mol·L-1的溶液中小于纯水电离产生的氢离子浓度,所以该溶液中存在大量的氢离子或氢氧根离子,四种离子在酸性或碱性条件下都不反应,可以大量共存,正确;C、常温下,c(H+)/c(OH-)=10-10的溶液中,c(OH-)=0.01mol/L,所以溶液呈碱性,在碱性溶液中Mg2+、HCO3-都与氢氧根离子反应,不能大量共存,错误;D、滴入少量KSCN溶液显红色的溶液中含有铁离子,而铁离子与I-反应生成亚铁离子和碘单质,不能大量共存,错误,答案选B。
考点:考查给定条件的离子大量共存的判断
本题难度:困难
4、选择题 某溶液中有Cu2+、NH4+、Fe3+ 和Al3+ 四种离子,若向其中加入过量的氢氧化钾溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
A.Cu2+
B.NH4+
C.Fe3+
D.Al3+
参考答案:B
本题解析:
对于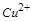 ,发生主要反应如下:加入
,发生主要反应如下:加入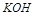 时
时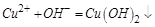 ,再加入过量盐酸时
,再加入过量盐酸时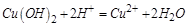 ,
,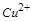 的数量在反应前后没有变化;
的数量在反应前后没有变化;
对于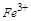 ,发生主要反应如下:加入
,发生主要反应如下:加入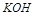 时
时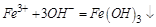 ,再加入过量盐酸时
,再加入过量盐酸时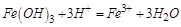 ,
,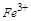 的数量在反应前后没有变化;
的数量在反应前后没有变化;
对于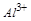 ,发生主要反应如下:加入
,发生主要反应如下:加入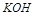 时
时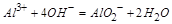 ,再加入过量盐酸时
,再加入过量盐酸时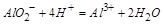 ,
,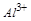 的数量在反应前后没有变化;
的数量在反应前后没有变化;
对于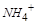 ,发生主要反应如下:加入
,发生主要反应如下:加入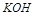 时
时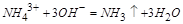 ,再加热,
,再加热,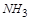 将从溶液中逸出,
将从溶液中逸出,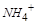 会大量减少
会大量减少
故正确答案为B
本题难度:一般
5、选择题 下列各组离子在对应溶液中可能大量存在的是
A.水电离出的c(H+)=10-12mol·L-1的溶液:K+、Cu2+、SO32-、MnO4-
B.与铝粉反应能放出氢气的溶液:Na+、SO42-、HCO3-、Cl-
C.含有大量ClO-的溶液:H+、I-、SO42-、Cl-
D.pH=12的溶液:K+、Cl-、SO32-、SiO32-
参考答案:D
本题解析:A、水电离出的c(H+)=10-12mol·L-1的溶液可能为酸性或碱性,MnO4?能氧化SO32?,碱性时Cu2+与OH?反应生成Cu(OH)2沉淀,不能大量共存;B、与铝粉反应能放出氢气的溶液可能为酸性或碱性,HCO3?既能与H+反应,也能与OH?反应,不能大量共存;C、ClO?具有强氧化性,能氧化I?反应,不能大量共存;D、pH=12的溶液呈碱性,各离子互不反应,能大量共存。
考点:本题考查离子共存。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《化学平衡状.. | |