微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 沼气是一种能源,它的主要成分是CH4。0.5mol CH4完全燃烧生成CO2和H2O(l),放出445 kJ热量,则下列热化学方程式中正确的是
[? ]
A.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH == +890 kJ·mol-1
B.CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH == +890 kJ·mol-1
C.CH4(g) + 2O2(g) == CO2(g) + 2H2O(l) ΔH == -890 kJ·mol-1
D. CH4(g) + O2(g) ==
CH4(g) + O2(g) == 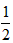 CO2(g) +H2O(l) ΔH == -890 kJ·mol-1
CO2(g) +H2O(l) ΔH == -890 kJ·mol-1
参考答案:C
本题解析:
本题难度:一般
2、填空题 (3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:298K时,
C(s,石墨)+ O2(g)= CO2(g) △H1= -393.5kJ/mol
2H2(g)+ O2(g)==2H2O (l) △H2= -571.6kJ/mol
2C2H2(g)+ 5O2(g)==4CO2(g) + 2H2O (l) △H3= -2599kJ/mol
写出298K时C(s,石墨)和H2(g)生成1mol C2H2(g)的热化学反应方程式:_____________
参考答案:2C(s,石墨)+ H2(g)= C2H2(g) △H3=+226.7kJ/mol
本题解析:考查盖斯定律的应用。根据反应①C(s,石墨)+ O2(g)= CO2(g) △H1= -393.5kJ/mol、
反应②2H2(g)+ O2(g)==2H2O (l) △H2= -571.6kJ/mol和反应③2C2H2(g)+ 5O2(g)==4CO2(g) + 2H2O (l) △H3= -2599kJ/mol可知,将①×4+②-③得到4C(s,石墨)+ 2H2(g)= 2C2H2(g),所以该反应的反应热△H=-393.5kJ/mol×4—571.6kJ/mol+2599kJ/mol=+453.4 kJ/mol。
本题难度:一般
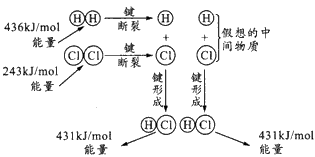
3、选择题 如图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是
[? ]
A.1 mol H2中的化学键断裂时需要吸收436 kJ能量
B.2 mol HCl分子中的化学键形成时要释放862 kJ能量
C.此反应的热化学方程式为H2(g) +Cl2(g)=2HCl(g) △H=+183 kJ/mol
参考答案:C
本题解析:
本题难度:一般
4、填空题 2008年北京奥运会所用火炬燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷(C3H8),已知常温下1mol丙烷燃烧放出2220kJ热量,1mol正丁烷燃烧放出2878kJ热量,1mol异丁烷燃烧放出2869.6kJ热量.试回答下列问题:
(1)表示正丁烷燃烧的热化学反应方程式______;
(2)下列有关说法正确的是______;
A.奥运火炬燃烧时的能量转化主要是由化学能转变为热能
B.相同条件下,正丁烷的热值比丙烷大
C.正丁烷比异丁烷不稳定
D.异丁烷分子中的碳氢键比正丁烷的多
(3)已知1mol?H2燃烧生成液态水放出热量是285.8kJ,现有5mol?氢气和丙烷的混合气体,完全燃烧时放热3847kJ,则氢气和丙烷的体积比为______.
参考答案:(1)1mol正丁烷燃烧放出2878kJ热量,常温下反应生成的水为液体,依据热化学方程式书写方法写出热化学方程式:C4H10(正丁烷,g)+13/2O2(g)→4CO2(g)+5H2O(l)△H=-2878 kJ?mol-1,
故答案为:C4H10(正丁烷,g)+13/2O2(g)→4CO2(g)+5H2O(l)△H=-2878?kJ?mol-1;
(2)A、燃料燃烧放热,化学能转化为热能,故A正确;
B、依据热值含义分析计算比较;1千克(每立方米)某种固体(气体)燃料完全燃烧放出的热量称为该燃料的热值;正丁烷热值=49.6,丙烷热值=22204450.45,相同条件下,正丁烷的热值比丙烷小,故B错误;
C、依据燃烧热化学方程式的焓变分析,1mol正丁烷燃烧放热小于异丁烷燃烧放热,说明异丁烷能量高于正丁烷,能量越高越不稳定;正丁烷比异丁烷不稳定,故C正确;
D、异丁烷分子中的碳氢键和正丁烷的相同,故D错误;
故答案为:AC;
(3)1mol丙烷燃烧放出2220kJ热量,1mol H2燃烧生成液态水放出热量是285.8kJ,设5mol 氢气和丙烷的混合气体中丙烷物质的量为x,氢气为5-x,
2220x+(5-x)285.8=3847
x=1.25mol,氢气物质的量3.75mol,氢气和丙烷的体积比等于氢气和丙烷的物质的量之比=3.75:1.25=3:1,
故答案为:3:1.
本题解析:
本题难度:一般
5、填空题 (12分)氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式 。

(2)已知:H-H、N≡N键能分别为435kJ·mol-1、943kJ·mol-1,则结合(1)图中数据,计算N-H的键能 kJ·mol-1。
(3)已知:N2(g)+2O2(g) N2O4(l);△H1=" -19.5" kJ·mol-1;
N2H4(l)+O2(g) N2(g)+2H2O(g) ;△H2=" -534.2" kJ·mol-1
肼(N2H4)与氧化剂N2O4反应生成N2和水蒸气。写出该反应的热化学方程式 。
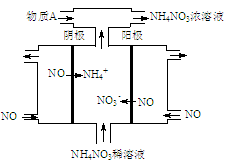
(4)工业上可电解NO制备NH4NO3,其工作原理如图所示,该阳极发生的电极反应式为 。为使电解产物全部转化为5mol NH4NO3,需补充的物质是 (填化学式),此时电子转移的物质的量为 mol。
参考答案:(1)N2(g) + 3H2(g) 2NH3(g) △H= -92kJ/mol
2NH3(g) △H= -92kJ/mol
(2)390 (3)2N2H4(l)+N2O4(l)= 3N2(g) + 4H2O(g) △H= -1048.9 kJ/mol
(4)NO-3e-+2H2O=NO3-+4H+ 氨气 15
本题解析:(1)根据图示,反应热为E1-E2=254-300=92kJ/mol,所以热化学方程式写成:N2(g) + 3H2(g) 2NH3(g) △H= -92kJ/mol(2)根据反应热=反应物的键能总和-生成物的键能总和计算,-92=943+3×435-6x, x=390kJ·mol-1。(3)将方程式标记为①和②,根据盖斯定律,②×2-①,计算反应热=-534.2×2+19.5=-1048.9 kJ/mol。(4)阳极反应是一氧化氮失去电子变成了硝酸根离子,即为NO-3e-+2H2O=NO3-+4H+,总反应为8 NO+2NH3+7H2O=5NH4NO3,所以为使电解产物全部转化为5mol NH4NO3,需补充的物质是氨气,此时电子转移的物质的量为15mol。
2NH3(g) △H= -92kJ/mol(2)根据反应热=反应物的键能总和-生成物的键能总和计算,-92=943+3×435-6x, x=390kJ·mol-1。(3)将方程式标记为①和②,根据盖斯定律,②×2-①,计算反应热=-534.2×2+19.5=-1048.9 kJ/mol。(4)阳极反应是一氧化氮失去电子变成了硝酸根离子,即为NO-3e-+2H2O=NO3-+4H+,总反应为8 NO+2NH3+7H2O=5NH4NO3,所以为使电解产物全部转化为5mol NH4NO3,需补充的物质是氨气,此时电子转移的物质的量为15mol。
考点:热化学方程式的书写,电解原理的应用。
本题难度:一般