微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:
(1)用太阳能分解5mol液态水消耗的能量是______kJ;
(2)液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为______;
(3)在以甲醇为燃料的燃料电池中,电解质溶液为酸性,则正极的电极反应式为______;?理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______.(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
参考答案:(1)H2的燃烧热△H分别为-285.8kJ?mol-1,分解5mol液态水消耗的能量为5mol×285.8kJ?mol-1=1429kJ,
故答案为:1429kJ;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ?mol-1和-726.5kJ?mol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ?mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-726.5kJ?mol-1-(-283.0kJ?mol-1)=-443.5kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1;
(3)甲醇燃料电池,甲醇在负极失电子发生氧化反应,氧气在正极放电,酸性条件下生成水,正极电极反应式为:O2+4e-+4H+═2H2O,
CH3OH(l)的燃烧热△H=-726.5kJ?mol-1,故2mol甲醇完全燃烧放出的热量为2mol×726.5kJ?mol-1=1453kJ,故该燃料电池的理论效率为1162.4kJ1453kJ=80%,
故答案为:O2+4e-+4H+═2H2O;80%.
本题解析:
本题难度:一般
2、填空题 (12分)(1)已知C(s、金刚石)+O2==CO2(g) ΔH=-395.4kJ/mol,
C(s、石墨)+O2==CO2(g) ΔH=-393.5kJ/mol。
①石墨和金刚石相比,石墨的稳定性 金刚石的稳定性。
②石墨中C-C键键能______金刚石中C-C键键能。(均填“大于”、“小于”或“等于”)。
(2)肼(N2H4)和NO2是一种双组分火箭推进剂。两物质混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为: 。
(3)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为: ;
又知H2O(l)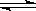 H2O(g),△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ。
H2O(g),△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ。
参考答案:(1)大于; 大于。
(2)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1136kJ/mol
(3)B2H6(g)+3O2(g)=B2O3(s)+3H2O(l);△H=-2165kJ/mol 1016.5kJ
本题解析:(1)①通过分析已知热化学方程式可知,金刚石所含能量高,能量越低越稳定,所以石墨比较稳定;②△H=反应物键能-生成物键能,两反应中只要石墨和金刚石不同,从△H的值可分析出,石墨的键能大;(2)8gN2H4的物质的量为 =0.25mol,则1molN2H4反应放出的热量为
=0.25mol,则1molN2H4反应放出的热量为 ×142KJ=568KJ,其热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1136KL/mol;(3)0.3mol的气态乙硼烷燃烧放出的热量为649.5KJ,则1mol气态乙硼烷燃烧放出的热量为
×142KJ=568KJ,其热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1136KL/mol;(3)0.3mol的气态乙硼烷燃烧放出的热量为649.5KJ,则1mol气态乙硼烷燃烧放出的热量为 ×649.5KJ=2165KJ,则其热化学方程式为:B2H6(g)+3O2(g)=B2O3(g)+3H2O(l) △H=-2165KJ/mol;标准状况下11.2L乙硼烷为0.5mol,完全燃烧生成1.5mol液态水放热2165KJ÷2=1082.5KJ,又知H2O(l)?H2O(g) △H=+44kJ/mol,则1.5mol液态水变为水蒸气需吸热1.5mol×44KJ/mol=66KJ,则放热1082.5KJ-66KJ=1016.5KJ。
×649.5KJ=2165KJ,则其热化学方程式为:B2H6(g)+3O2(g)=B2O3(g)+3H2O(l) △H=-2165KJ/mol;标准状况下11.2L乙硼烷为0.5mol,完全燃烧生成1.5mol液态水放热2165KJ÷2=1082.5KJ,又知H2O(l)?H2O(g) △H=+44kJ/mol,则1.5mol液态水变为水蒸气需吸热1.5mol×44KJ/mol=66KJ,则放热1082.5KJ-66KJ=1016.5KJ。
考点:考查反应热和焓变。
本题难度:一般
3、填空题 (14分)
(1)纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)= ;
若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)= 。
(2)在CH3COONa的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)明矾的水溶液显酸性,其原因是(用离子方程式表示) 。
(4)在25℃、101kPa下,0.5mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 。
(5)1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为 。
(6)已知:①N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol ;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4与NO2与完全反应生成氮气和气态水的热化学方程式为 。
参考答案:(1)5.0×10-7mol/L (2分) 5.0×10-11mol/L(2分)
(2)c( Na+) > c(CH3COO-) > c( OH-)> c(H+)(2分),
(3)Al3+ + 3H2O  Al(OH)3 + 3H+(2分) Al(OH)3;
Al(OH)3 + 3H+(2分) Al(OH)3;
(4)CH3OH (l)+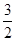 O2 (g) 来源:91exam .org=CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1
O2 (g) 来源:91exam .org=CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1
(5)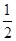 H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=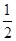 Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(2分)
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(2分)
(6)2 N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1 (2分)
或写成2N2H4 (g) + NO2 (g) =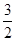 N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1
N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1
本题解析:(1)在纯水中存在电离平衡:H2O H++OH-,纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)=5.0×10-7mol/L. Kw=2.5×10-13;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)=Kw÷c(H+)=2.5×10-13÷5.0×10-3=5.0×10-11mol/L;(2)在CH3COONa的溶液中,由于CH3COO-水解消耗,所以c( Na+) > c(CH3COO-);水解消耗水电离产生的H+,破坏了水的电离平衡,最终使溶液中的OH-的浓度大于H+的浓度,c( OH-)> c(H+)。但是盐的水解程度是微弱的,盐电离产生的离子浓度远大于水电离产生的离子的浓度,所以c(CH3COO-) > c( OH-) c(H+)。故各离子的物质的量浓度由大到小的顺序是c( Na+) > c(CH3COO-) > c( OH-)> c(H+);(3)明矾的水溶液显酸性,其原因是Al3+ + 3H2O
H++OH-,纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)=5.0×10-7mol/L. Kw=2.5×10-13;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)=Kw÷c(H+)=2.5×10-13÷5.0×10-3=5.0×10-11mol/L;(2)在CH3COONa的溶液中,由于CH3COO-水解消耗,所以c( Na+) > c(CH3COO-);水解消耗水电离产生的H+,破坏了水的电离平衡,最终使溶液中的OH-的浓度大于H+的浓度,c( OH-)> c(H+)。但是盐的水解程度是微弱的,盐电离产生的离子浓度远大于水电离产生的离子的浓度,所以c(CH3COO-) > c( OH-) c(H+)。故各离子的物质的量浓度由大到小的顺序是c( Na+) > c(CH3COO-) > c( OH-)> c(H+);(3)明矾的水溶液显酸性,其原因是Al3+ + 3H2O  Al(OH)3 + 3H+;(4)燃烧热是1mol的可燃物完全燃烧产生稳定的氧化物时所放出的热量,根据题意可得甲醇燃烧热的热化学方程式为CH3OH (l)+
Al(OH)3 + 3H+;(4)燃烧热是1mol的可燃物完全燃烧产生稳定的氧化物时所放出的热量,根据题意可得甲醇燃烧热的热化学方程式为CH3OH (l)+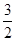 O2 (g)=CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1;(5)中和热是酸碱发生中和反应产生1mol的水时所放出的热量,由于1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为
O2 (g)=CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1;(5)中和热是酸碱发生中和反应产生1mol的水时所放出的热量,由于1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为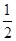 H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=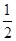 Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;(6)②×2-①,整理可得2 N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1或写为2N2H4 (g) + NO2 (g) =
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;(6)②×2-①,整理可得2 N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1或写为2N2H4 (g) + NO2 (g) =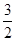 N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1。
N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1。
考点:考查弱电解质的电离、水的离子积常数、盐的水解、盖斯定律的应用、离子浓度比较、中和热、燃烧热的热化学方程式的书写的知识。
本题难度:一般
4、填空题 化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化
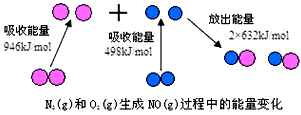
(1)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N的键能为___________ kJ/mol,由上图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式_______________________
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①根据下列反应的热化学反应式,计算由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H。
C(石墨)+ O2(g)= CO2(g);△H1 = - 393.5 kJ/mol
2H2(g)+ O2(g)= 2H2O(l);△H2 = - 571.6 kJ/mol
2C2H2(g)+ 5O2(g)= 4CO2(g)+ 2H2O(l);△H3 = - 2599.2 kJ/mol,
则由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H __________________kJ/mol。
②已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1mol C与O2反应生成CO的反应热△H为_________
参考答案:(1)946kJ/mol;N2(g)+ O2(g)= 2NO(g)△H = +180 kJ/mol
(2)① +226.8 kJ/mol;②-(5X-0.5Y)kJ/mol
本题解析:
本题难度:一般
5、填空题 (1)已知H-H的键能是为436.0kJ?mol-1、Cl-Cl的键能是为242.7kJ?mol-1、H-Cl的键能是为431.8kJ?mol-1.试写出氢气和氯气反应的热化学方程式:______.
(2)已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol;H2(g)+
O2(g)═H2O(1)△H=-285.8kJ/mol,由此可知,蒸发45g液态水成气体需吸收______kJ的热量.
参考答案:(1)反应为H2+Cl2=2HCl,焓变=反应物键能之和-生成物键能之和=436.0kJ?mol-1+242.7kJ?mol-1-2×431.8kJ?mol-1=-184.9KJ/mol;
氢气和氯气反应的热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H=-184.9kJ/mol;
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-184.9kJ/mol;
(2)①2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol;
②H2(g)+12O2(g)═H2O(1)△H=-285.8kJ/mol,
依据盖斯定律①÷2-②,得到H2O(1)=H2O(g)△H=44KJ/mol;
蒸发45g液态水物质的量为2.5mol,生成气体水需吸收热量=2.5mol×44KJ/mol=110KJ;
故答案为:110
本题解析:
本题难度:一般