|
高中化学知识点讲解《难溶电解质的溶解平衡》试题强化练习(2017年最新版)(八)
2017-09-24 00:01:38
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 (1)已知t ℃时AgCl的Ksp=2×10-10;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )。

A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C.在t℃时,以0.01 mol/L AgNO3溶液滴定20 mL0.01 mol/LKCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
|
参考答案:C
本题解析:A、依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s)?2Ag+CrO42-,Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,错误;B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,错误;C、依据溶度积常数计算Ksp(CrO42-)=c2(Ag+)c(CrO42-)=1×10-12;Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,以0.01mol/L AgNO3溶液滴定20mL0.01mol/L KCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42-)=0.01mol/L,得到c(Ag+)=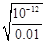 =10-5mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)=2×10?10÷0.01=2×10-8mol/L,所以先析出氯化银沉淀,正确;D、则S(AgCl)= =10-5mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)=2×10?10÷0.01=2×10-8mol/L,所以先析出氯化银沉淀,正确;D、则S(AgCl)=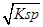 = =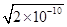
=1.41×10-5,而S(Ag2CrO4)= =3/2 =3/2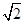 ×10-4,所以在t℃时,AgCl的溶解度小于Ag2CrO4,错误。 ×10-4,所以在t℃时,AgCl的溶解度小于Ag2CrO4,错误。
考点:本题考查沉淀溶解平衡。
本题难度:一般
2、选择题 下列实验现象、解释与结论均正确的是
编号
| 实验操作
| 实验现象
| 解释与结论
| A
| 铜与浓硝酸反应,生成气体用湿润KI-淀粉试纸检验
| 试纸变蓝
| NO2为酸性气体
| B
| 向某溶液中加入稀盐酸酸化的BaCl2溶液
| 有白色沉淀产生
| 该沉淀可能是BaSO4,该溶液中可能含有SO42-
| C
| 向甲苯中滴入少量浓溴水,振荡,静置
| 溶液分层,上层呈橙红色,下层几乎无色
| 甲苯和溴水发生取代反应,使溴水褪色
| D
| 在稀AgNO3溶液中先加入过量0.1mol/L NaCl溶液,再加入少量0.1mol/L NaI溶液
| 先产生白色沉淀,后出现黄色沉淀
| 说明Ksp(AgCl)>Ksp(AgI)
|
?
参考答案:BD
本题解析: 铜与浓硝酸反应生成的气体为NO2,能使湿润的KI-淀粉试纸变蓝,是因为跟水反应生成硝酸,硝酸把I-离子氧化为碘单质的,所以不能得出NO2为酸性气体的结论,A错误;检验硫酸根的试剂盐酸和氯化钡一定要先后分开滴加,否则不能排除Ag+的干扰,所以得到的结论只能是可能含有SO42- ,B项正确;甲苯和浓溴水不发生反应,造成溶液分层,上层呈橙红色,下层几乎无色的现象是发生了萃取,所以C错误;D实验中白色沉淀转化为黄色沉淀是发生了沉淀的转化,易溶的沉淀转化为更加难溶的沉淀,所以Ksp(AgCl)>Ksp(AgI)是正确的;故选BD。
本题难度:一般
3、选择题 常温下Ca(OH)2溶于水达饱和时存在如下平衡:?Ca(OH)2(s)?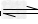 ?Ca(OH)2(aq), Ca(OH)2(aq)==Ca2+ +2OH-?饱和石灰水的密度为d?g/cm3,溶液的pH=12。则该温度下Ca(OH)2的溶解度为 ?Ca(OH)2(aq), Ca(OH)2(aq)==Ca2+ +2OH-?饱和石灰水的密度为d?g/cm3,溶液的pH=12。则该温度下Ca(OH)2的溶解度为
[? ]
A.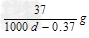 ? ?
B.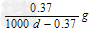 ? ?
C.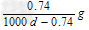 ? ?
D. ? ?
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列化学实验事实及解释都正确的是
A.用滴有少量硫酸铜溶液的稀硫酸跟锌粒反应快速地制氢气,说明Cu2+具有催化能力
B.等体积、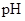 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: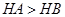
C.升高温度会加快化学反应速率,其原因是增加了单位体积内活化分子的百分数
D.向浓度均为0.1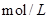 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]。 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]。
参考答案:C
本题解析:选项A中锌把铜置换出来,构成铜锌原电池加快反应速率,而不是催化剂。等体积、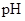 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA的浓度大于HB的,因此酸性弱于HB的。沉淀一般是向生成更难溶的方向转化,既然先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]<Ksp[Mg(OH)2],所以正确的答案是C。 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA的浓度大于HB的,因此酸性弱于HB的。沉淀一般是向生成更难溶的方向转化,既然先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]<Ksp[Mg(OH)2],所以正确的答案是C。
本题难度:一般
5、填空题 A.已知常温下,AgBr的Ksp=4.9×10-13,AgI的Ksp=8.3×10-17.
(1)通常情况下,AgBr呈______色,见光变______色;
(2)现向AgBr的悬浊液中:
①加入AgNO3固体,则c(Br-)______(填“变大”、“变小”或“不变”,下同);
②若改加更多的AgBr固体,则c(Ag+)______;
③若改加更多的KI固体,则c(Ag+)______,c(Br-)______;
(3)有关难溶盐的溶度积及溶解度有以下叙述,其中正确的是______;
A.将难溶电解质放入纯水中,溶解达到平衡时,升高温度,Ksp?一定增大
B.两种难溶盐电解质,其中Ksp小的溶解度也一定小
C.难溶盐电解质的Ksp与温度有关
D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变
B.最近有人制造了一种燃料电池使汽油氧化直接产生电流,其中一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.回答下列问题:
(1)以锌烷为汽油的代表物,则这个电池放电时必发生反应的化学方程式是______.
(2)这个电池负极的电极反应式为C8H18+25O2--50e-═8CO2+9H2O,,正极的电极反应式为______.固体电解质里O2-的移动方向是______,向外电路释放电子的电极是______.
参考答案:A、(1)溴化银是淡黄色固体,见光易分解为黑色的银和溴单质,故答案为:浅黄,黑;
(2)根据溴化银的沉淀溶解平衡:AgBr(s)?Ag+(aq)+Br-(aq),①加入AgNO3固体,增大银离子浓度,所以平衡向左移动,溴离子浓度减小,故答案为:变小;
②加更多的AgBr固体,因为已达到溶解平衡,所以固体不再溶解,溶液是饱和溶液,故银离子浓度不变,
故答案为:不变;
③加更多的KI固体,则碘离子和银离子之间反应,会转化为更难溶的沉淀碘化银,所以银离子浓度减小,平衡右移,溴离子浓度增大,故答案为:变小;变大;
(3)A、有的物质的溶解度随温度升高而增大,有的却是减小的,所以升高温度,Ksp不一定增大,故A错误;
B、如果难溶盐中阴阳离子个数相等,其中Ksp小的溶解度也一定小,故B错误;
C、难溶盐电解质的Ksp与温度有关,不受其他因素的影响,故C正确;
D、难溶盐电解质的Ksp与温度有关,不受其他因素的影响,溶解度只受温度的影响,不受其他因素的影响,故D正确.
故选CD.
B.(1)燃料电池的总反应和燃料燃烧的化学方程式一致,电池总反应为2C8H18+25O2═16CO2+80H2O,
故答案为:2C8H18+25O2=16CO2+18H2O;
(2)极发生还原反应,总反应减负极反应可得正极反应式,为O2+4e-=2O2-;原电池工作时,阴离子O2-向负极移动,电子从负极经外电路流向正极,即电子从负极释放出来,故答案为:O2+4e-═2O2-;向负极移动;负极.
本题解析:
本题难度:简单
|