|
高中化学知识点总结《原电池原理》试题特训(2017年最新版)(八)
2017-09-24 00:03:01
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中,正确的是
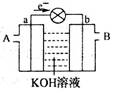
A.a电极发生还原反应,b电极发生氧化反应
B.a电极的电极反应式为:CO+4OH-+2e-=CO2+2H2O
C.A处通入的是空气,B处通入的是CO
D.用这种电池作电源精炼铜,若阴极质量增加6.4 g,则至少消耗标准状况下的CO 2.24 L
|
参考答案:D
本题解析:A.电子从a电极流出,则a电极是负极,因此a电极发生氧化反应,b电极发生还原反应,A错误;B.a电极通入的是CO,电极反应式为:CO+2OH-—2e-=CO2+H2O,B错误;C.A处通入的是CO,B处通入的是空气,C错误;D.用这种电池作电源精炼铜,若阴极质量增加6.4 g,即析出铜的质量是6.4g,物质的量是0.1mol,转移0.2mol电子,则根据方程式CO+2OH-—2e-=CO2+H2O可知至少消耗标准状况下的CO 2.24 L,D正确,答案选D。
考点:考查电化学原理的应用
本题难度:一般
2、简答题 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的______棒,乙池中的______棒.
②乙池中阳极的电极反应式是______.
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式______.
②甲池中碳极上电极反应式是______,乙池碳极上电极反应属于______(填“氧化反应”或“还原反应”).
③若乙池转移0.02mol?e-后停止实验,池中溶液体积是200mL,则溶液混合均匀后的所得NaOH溶液的物质的量浓度为______.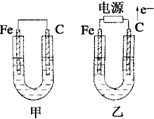
参考答案:(1)①甲池为原电池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,有Cu析出,乙池为电解池,外电路电子流向电源正极,所以碳棒为阳极,放出氯气,阴极铁电极上发生还原反应有Cu析出,故答案为:碳;铁;
②乙池中,惰性电极为阳极,电解硫酸铜溶液,阳极氢氧根离子放电生成氧气,电极反应为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(2)①若电解质溶液为饱和氯化钠溶液,则乙池就是用惰性电极为阳极电解氯化钠溶液,方程式为:2NaCl+2H2O?通电?.?Cl2↑+H2↑+2NaOH,
故答案为:2NaCl+2H2O?通电?.?Cl2↑+H2↑+2NaOH;
②甲池中碳棒为正极,发生还原反应,氧气得到电子生成氢氧根,与吸氧腐蚀的电极反应相同,O2+2H2O+4e-=4OH-,乙装置中,碳棒是阳极,发生失电子的氧化反应,
故答案为:O2+2H2O+4e-=4OH-;氧化反应;
③电解氯化钠溶液的方程式为:2NaCl+2H2O?通电?.?Cl2↑+H2↑+2NaOH,乙池转移0.02mole-后,会生成0.02mol的氢氧化钠,所以所得NaOH溶液的物质的量浓度c=nV=0.02mol0.2L=0.1mol/L,故答案为:0.1mol/L.
本题解析:
本题难度:一般
3、选择题 下列关于锌、铜和稀硫酸构成的原电池的说法中,正确的是(?)
A.锌是负极、铜是正极
B.电子从铜片经导线流向锌片
C.负极的反应式为2H++2e-=H2↑
D.反应一段时间后,溶液的pH升高
参考答案:AD
本题解析:由于锌比铜活泼,在形成的原电池中,锌是负极,铜是正极;电子从锌片经导线流向铜片;负极的反应式为Zn-2e-=Zn2+,正极的反应式为2H++2e-=H2↑;反应一段时间后,由于消耗了H+,溶液的pH升高。
本题难度:一般
4、填空题 某原电池中,电解质溶液为KOH(aq),分别向负极通入C2H4或Al(g),分别向正极通入O2或Cl2.试完成下列问题:
(1)当分别通入C2H4和O2时: ①正极反应:___________; ②负极反应:__________;
③电池总反应:________________________;
④溶液pH的变化:__________(填“增大”“减小”或“不变”,下同).
(2)当分别通入Al(g)和Cl2时:
①正极反应:_______________; ②负极反应:_______________;
③电池总反应:_______________; ④溶液pH的变化:_______________.
参考答案:(1)①3O2+12e-+6H2O=12OH-?②C2H4-12e-+16OH-=2CO32-+10H2O?
③C2H4+3O2+4OH-=2CO32-+4H2O? ④减小?
(2)①3Cl2+6e-=6Cl-?
?②2Al-6e-+6OH-=2Al(OH)3↓(或2Al-6e-+8OH-=2AlO2-+4H2O)?
③3Cl2+2Al+6OH-=2Al(OH)3↓+6Cl-(或3Cl2+2Al+8OH-=6Cl-+2AlO2-+4H2O)
④减小
本题解析:考查原电池中电极反应式的书写。
(1)原电池中正极得到电子,负极失去电子,所以乙烯在负极通入,氧气在正极通入。由于电解质是氢氧化钾,所以电极反应式分别是,正极:3O2+12e-+6H2O=12OH-;负极:C2H4-12e-+16OH-=2CO32-+10H2O 。正负极电极反应式合并即得到总反应式,即总反应式是C2H4+3O2+4OH-=2CO32-+4H2O;根据反应式可知,反应中消耗氢氧化钾,所以溶液的pH减小。
(2)金属铝失去电子,氯气得到电子,所以铝是负极,氯气在正极通入。由于电解质是氢氧化钾,所以电极反应式分别是,正极:3Cl2+6e-=6Cl-;负极:2Al-6e-+8OH-=2AlO2-+4H2O。正负极电极反应式合并即得到总反应式,即总反应式是3Cl2+2Al+8OH-=6Cl-+2AlO2-+4H2O;根据反应式可知,反应中消耗氢氧化钾,所以溶液的pH减小。
本题难度:一般
5、填空题 (10分)有A、B、C、D四种短周期元素,其原子序数依次增大。A、B可形成A2B和A 2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。 2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
(1) A2B2的电子式为____________。
(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1 L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图所示)。
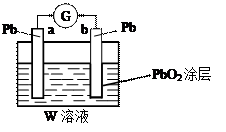
在b电极上发生的反应可表示为:PbO2+4H++SO +2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。 +2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。
(3)金属元素E是中学化学常见元 素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反 素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反 应的离子方程式为____________________________________。 应的离子方程式为____________________________________。
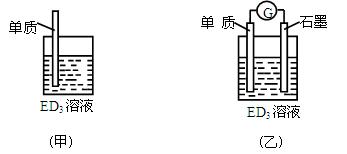 ? ?
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为______________________________。比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是___________________________________。
参考答案:(10分)(1)?双氧水的电子式
(2)Pb-2e-+SO =?PbSO4? (3)Fe+2Fe3+=?3Fe2+ =?PbSO4? (3)Fe+2Fe3+=?3Fe2+
(4)2Fe3++2e-=?2Fe2+?使还原反应和氧化反应在电解质溶液中的不同区域内发生
本题解析:略
本题难度:一般
|