微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA表示阿伏加德罗常数,下列叙述中正确的是
[? ]
A.常温常压下,11.2L氧气所含的原子数为NA
B.1.8g的NH4+离子中含有的电子数为11 NA
C.常温常压下,48g O3含有的氧原子数为3 NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1 NA
参考答案:C
本题解析:
本题难度:简单
2、计算题 (10分)将固体草酸锰MnC2O4·2H2O放在一个可以称出质量的容器中加热。固体质量随温度的变化关系如图所示。
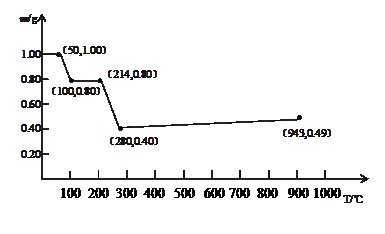
(1)214℃,剩余固体的成分为?(填写化学式,下同);280℃时,剩余固体的成分为?。
(2)当温度超过280℃时,剩余固体的质量又会增加,943℃完全生成另一种固体物质,则280℃-943℃过程中发生反应的化学方程式为?。
(3)草酸锰受热可生成MnO2,MnO2是一种重要的无机功能材料,在硫酸锰溶液中加入NaClO可生成MnO2和Cl2,请写出向硫酸锰溶液中加入NaClO时发生反应的化学方程式?。
参考答案:(1)MnC2O4; MnO--------6分(3分+3分)
(2)2MnO + O2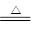 2MnO2------2分
2MnO2------2分
(3)MnSO4 + 2NaClO = MnO2 + Cl2 ↑+ Na2SO4-------2分
本题解析:(1)1gMnC2O4·2H2O中结晶水的质量是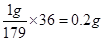 。根据图像可知,214℃固体质量减少2hi0.2g,所以此时固体是MnC2O4;设此时固体的摩尔质量是x,则
。根据图像可知,214℃固体质量减少2hi0.2g,所以此时固体是MnC2O4;设此时固体的摩尔质量是x,则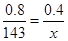 ,解得x=71,所以是MnO。
,解得x=71,所以是MnO。
(2)空气中含有氧气,所以在加热的条件下,能把MnO氧化。设此时固体的摩尔质量是y,则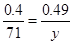 ,解得y=87,所以应该是二氧化锰,方程式为2MnO + O2
,解得y=87,所以应该是二氧化锰,方程式为2MnO + O2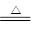 2MnO2。
2MnO2。
(3)次氯酸钠的还原产物是氯气,1mol氧化剂得到1mol电子,而1mol还原剂失去2mol电子,所以方程式为MnSO4 + 2NaClO = MnO2 + Cl2 ↑+ Na2SO4。
本题难度:一般
3、选择题 摩尔是
[? ]
A.国际单位制的一个基本物理量
B.表示物质质量的单位
C.物质的量的单位
D.可以计量任何物质的单位
参考答案:C
本题解析:
试题分析:
解:A、物质的量是国际单位制中的应该基本物理量,故A错误;
B、物质质量的单位是克,不是摩尔,故B错误;
C、摩尔是物质的量的单位,故C正确;
D、摩尔只能描述微观粒子,不能表示宏观物质,故D错误;
故选C.
本题难度:简单
4、选择题 在用浓盐酸与MnO2共热制取Cl2的反应中,消耗的HCl的物质的量与作还原剂的HCl的物质的量之比是(?)
A.1∶1
B.1∶2
C.2∶1
D.4∶1
参考答案:C
本题解析:MnO2+4HCl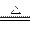 MnCl2+Cl2↑+2H2O中,参加反应的HCl为4 mol时,其中作为还原剂的HCl为2 mol。
MnCl2+Cl2↑+2H2O中,参加反应的HCl为4 mol时,其中作为还原剂的HCl为2 mol。
本题难度:简单
5、选择题 MgCl2、KCl、K2SO4 3种盐配成混合液后,若溶液中n(K+)=1.5 mol、
n(Mg2+)=0.5 mol、n(Cl-)=1.5 mol,则溶液中n(SO42-)应为
A.0.5 mol
B.0.25 mol
C.0.15 mol
D.1 mol