微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题
|
在容积固定为2L密闭容器中,充入X、Y各2mol发生可逆反应:X(g)+2Y(g) 2Z(g)达到平衡,以Y的浓度改变表示的化学反应速率、与时间的关系如图所示,则Y的平衡浓度的表达式正确的是(式中S指对应区域的面积)
2Z(g)达到平衡,以Y的浓度改变表示的化学反应速率、与时间的关系如图所示,则Y的平衡浓度的表达式正确的是(式中S指对应区域的面积)
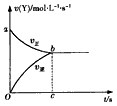
[? ]
A.
B.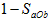
C.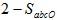
D.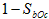
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
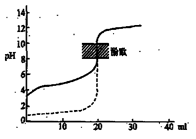
A.△H>0的反应,常温下一定不能自发进行
B.用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线
C.常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小
D.恒容密闭容器中进行的反应3A(g) 2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
参考答案:C
本题解析:A.由公式△G=△H—T△S可知,当△H>0时,常温下有可能自发进行(能保证△G小于0即可),错误
B.盐酸为强酸,酸性相对强,pH较醋酸小,错误
C.常温下,在0.1mol/L氨水中:NH3·H2O NH4++OH—,加入少量NH4Cl晶体,由于同离子效应,平衡左移,OH—浓度减小,溶液的pH减小,正确
NH4++OH—,加入少量NH4Cl晶体,由于同离子效应,平衡左移,OH—浓度减小,溶液的pH减小,正确
D.再充入一定量的A气体,相当于加压,平衡向气体系数减小(C为固体)的方向移动,A的转化率增大
故答案为C
本题难度:一般
3、选择题 下列事实不能用勒夏特列原理解释的是?(? )
A.钢铁在潮湿的空气中易生锈
B.Fe(SCN)3溶液中加入固体KSCN后颜色加深
C.实验室可用排饱和食盐水的方法收集氯气
D.室温下,将1mLpH=3的醋酸溶液加水稀释至100mL后,测得其pH<5
参考答案:A
本题解析:如果改变影响平衡的一个条件,平衡就能够向减弱这种改变的方向移动,这就是勒夏特列原理。钢铁在潮湿的空气中易生锈,属于电化学腐蚀,不能用勒夏特列原理解释。BCD均属于浓度对平衡的影响,所以答案是A。
本题难度:一般
4、选择题 在某一容积为2L的密闭容器内,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=a?kJ/mol(a>0)反应达到平衡后,测得c(CO):c(CO2)=3:2.下列说法正确的是( )
A.反应放出的热量为0.2akJ
B.平衡时H2O的转化率为40%
C.若升高温度,v(正)加快,v(逆)减慢,平衡正向移动
D.若将容器的体积压缩为1?L,有利于该反应平衡正向移动
参考答案:设达到平衡时,CO转化xmol,利用三段式法计算,
? ?CO(g)+H2O(g)?CO2(g)+H2(g)
起始:0.2mol? 0.2mol? 0?0
转化:xmol?xmol? xmol? xmol
平衡:(0.2-x)mol (0.2-x)mol? xmol? xmol
则有(0.2-x):x=3:2
x=0.08mol,
A.反应放出的热量为0.08akJ,故A错误;
B.平衡时H2O的转化率为0.08mol0.2mol×100%=40%,故B正确;
C.若升高温度,正逆反应速率都增大,故C错误;
D.反应前后气体的体积不变,压强对平衡移动无影响,故D错误.
故选B.
本题解析:
本题难度:一般
5、选择题 在容积不变的密闭容器中,一定条件下发生反应:2A  ?B(g)+ 2C(g),且达到平衡。当升高温度时,气体的密度增大,则下列叙述中正确的是(?)
?B(g)+ 2C(g),且达到平衡。当升高温度时,气体的密度增大,则下列叙述中正确的是(?)
A.升高温度,正反应速率增大,逆反应速率减小
B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应
D.若向容器中充入惰性气体,则平衡向右移动
参考答案:C
本题解析:升高温度气体的密度增大,由于容器的容积不变所以气体的总体积不发生变化,要使密度增大则气体的质量增大,B和C都是气体那么A是非气体,升高温度正逆反应速率都增大,所以A和B都错误;升高温度平衡气体密度增大,说明平衡向正反应方向移动,所以正反应方向是吸热的方向,C正确;向容器中充入惰性气体,由于容器的体积不发生变化各物质的浓度不发生变化,平衡不发生移动,D错误;所以答案选C。
本题难度:简单