微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知CH4(g)+2O2(g)=2CO2(g)+2H2O(l);△H=-Q1kJ/mol,2H2(g)+O2(g)=2H2O(g) ;△H=-Q2 kJ/mol,2H2(g)+O2(g)=2H2O(l) ;△H=-Q3 kJ/mol,常温下取体积比为4:1的CH4和H2的混合气11.2L(标况)经完全燃烧后恢复至常温,放出的热量是?( ?)?
A.0.4Q1+0.05Q3
B.0.4Q1+0.05Q2
C.0.4Q1+0.1Q3
D.0.4Q1+0.2Q2
参考答案:A
本题解析:试题分析:混合气的物质的量是0.5mol,其中甲烷是0.4mol,氢气是0.1mol。由于是恢复到常温下,所以生成物水是液态,因此反应中放出的热量是0.4Q1+0.05Q3,答案选A。
考点:考查反应热的有关计算
点评:该题是常识性知识的考查,试题基础性强,难度不大。该题的关键是明确水的状态,然后根据题意列式计算即可。
本题难度:困难
2、选择题 灰锡(以粉末状存在)和白锡是锡元素的两种不同单质。已知在温度低于13.2 ℃时白锡转化为灰锡,转化过程的能量变化如右图所示,则下列说法正确的是
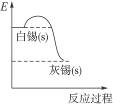
A.完全燃烧等质量白锡和灰锡,灰锡放出的热量更多
B.锡在常温下以灰锡状态存在
C.白锡转化为灰锡的反应为吸热反应
D.白锡制造的器皿长期处于低于13.2 ℃的环境中,会自行毁灭
参考答案:D
本题解析:从白锡转化为灰锡能量变化图看,由白锡转化为灰锡是放热反应,C项错误;完全燃烧等质量白锡和灰锡,灰锡放出的热量更少,A项错误;由题给信息知,锡在常温下以白锡状态存在,温度低于13.2 ℃?时白锡转化为灰锡,B项错误,D项正确。
本题难度:简单
3、填空题 (8分)某氮肥厂氨氮废水中氮元素多以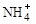 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下:
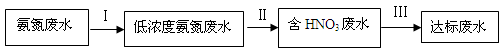
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用: 。
(2)过程Ⅱ:在微生物作用的条件下,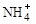 经过两步反应被氧化成
经过两步反应被氧化成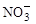 。其中第一步反应的能量变化示意图如下:
。其中第一步反应的能量变化示意图如下:
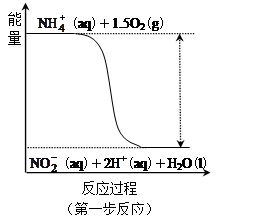
第一步反应是 反应(选填“放热”或“吸热”),判断依据是
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
参考答案:(1) NH4++OH-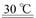 NH3↑+H2O (2分)
NH3↑+H2O (2分)
(2)放热(1分);反应物总能量高于生成物总能量(2分); (3)5∶6(3分)
本题解析:(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用是H4++OH-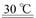 NH3↑+H2O;(2)根据图示可知:反应物的能量高三生成物的能量,所以当反应发生时多余的能量就释放出来,因此第一步反应是放热反应;(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,甲醇在反应中失去电子,作还原剂,而硝酸在反应中得到电子,作氧化剂,甲醇将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,每1mol的稀释在反应中得到5mol的电子。根据氧化还原反应中电子转移的数目相等可得:参加反应的还原剂和氧化剂的物质的量之比是5∶6。
NH3↑+H2O;(2)根据图示可知:反应物的能量高三生成物的能量,所以当反应发生时多余的能量就释放出来,因此第一步反应是放热反应;(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,甲醇在反应中失去电子,作还原剂,而硝酸在反应中得到电子,作氧化剂,甲醇将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,每1mol的稀释在反应中得到5mol的电子。根据氧化还原反应中电子转移的数目相等可得:参加反应的还原剂和氧化剂的物质的量之比是5∶6。
考点:考查离子方程式的书写、反应热与物质能量的关系、氧化还原反应中的概念和电子转移的关系的知识。
本题难度:一般
4、选择题 下列各组物质的晶体中,化学键类型相同、晶体类型都相同的是(? )
A.CO2和SiO2
B.C60和C(金刚石)
C.NaCl和HCl
D.CO2和H2O
参考答案:D
本题解析:CO2、C60、HCl属于分子晶体,SiO2、金刚石属于原子晶体,NaCl属于离子晶体,故A、B、C错误;CO2、H2O都属于分子晶体且分子内原子间形成的化学键都是共价键,故D正确。
本题难度:一般
5、选择题 既有离子键又有共价键和配位键的化合物是( )
A.NH4NO3
B.NaOH
C.H2SO4
D.H2O
参考答案:A
本题解析:由于H2SO4、H2O分子中不含离子键,所以首先排除C、D选项。
由于NaOH的电子式为: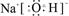 ,即H、O原子间的共用电子对是H、O双方提供的,所以NaOH中无配位键。则B被排除。由此已知答案。NH4NO3的电子式为:
,即H、O原子间的共用电子对是H、O双方提供的,所以NaOH中无配位键。则B被排除。由此已知答案。NH4NO3的电子式为: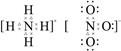 ,其结构式为:
,其结构式为: ,其中离子键1个,不是配位键的共价键(3+1)个,配位键(1+2)个。
,其中离子键1个,不是配位键的共价键(3+1)个,配位键(1+2)个。
本题难度:一般