|
高考化学知识点整理《物质的量》考点特训(2017年冲刺版)(四)
2017-09-24 00:21:57
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图是某硫酸试剂瓶的标签上的部分信息。下列说法正确的是
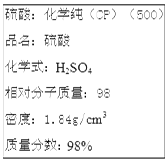
A.常温下,该试剂可与金属铝反应生成大量的无色气体
B.1 mol Zn与足量的该硫酸反应生成2 g氢气
C.该硫酸与等体积水混合所得溶液的物质的量浓度大于9.2 mol/L
D.向50 mL该硫酸中加入足量的铜片,加热,反应后被还原的硫酸的物质的量小于0.46 mol
|
参考答案:CD
本题解析:A.该硫酸是浓硫酸。常温下,浓硫酸遇金属铝会发生钝化,不能继续反应,因此不会生成大量的无色气体,错误;B.1 mol Zn与足量的该硫酸发生反应产生SO2,不能产生氢气,错误;C.由于硫酸浓度越大,密度就越大,所以该硫酸与等体积水混合所得溶液的物质的量浓度大于9.2 mol/L,正确;D.该硫酸的物质的量浓度是18.4mol/L,50 mL该硫酸中溶质的物质的量浓度是0.92mol,若硫酸完全反应,被还原的硫酸是0.46mol,但是只有浓硫酸能够与Cu发生反应,随着反应的进行,硫酸变为稀硫酸,反应就不再发生,因此向50 mL该硫酸中加入足量的铜片,加热,反应后被还原的硫酸的物质的量小于0.46 mol,正确。
考点:考查浓硫酸的性质、稀释、及发生反应的原理及相应计算的知识。
本题难度:一般
2、选择题 以NA表示阿伏伽德罗常数,下列说法正确的是
A.1molNH4+含有10NA个质子
B.T℃时1LpH=6的纯水中,含10—6NA个OH—
C.78gNa2O2离子化合物中含阴离子的个数是2NA
D.0.01molMg在CO2中燃烧转移电子数为0.01NA
参考答案:B
本题解析:略
本题难度:一般
3、填空题 森林是大自然的清洁器,一亩森林一昼夜可吸收66kg二氧化碳,呼出48kg氧气,即在标准状况下吸收 ____ L二氧化碳,呼出 ______ mol氧气。
参考答案:3.36×104 1.5×103
本题解析:略
本题难度:一般
4、实验题 为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取25.00 mL上述溶液,加入过量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g 。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g 。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、胶头滴管、药匙和__________________、_________________。
(2)写出Na2SO3固体氧化变质的化学方程式__________________________________。
(3)方案I加入过量的盐酸酸化的BaCl2溶液,目的是_____________________________,在过滤前,需要检验是否沉淀完全,其操作是___________________________。
(4)方案I中,若滤液浑浊,将导致测定结果____________(选填“偏高”或“偏低”)。
(5)若操作正确,则m1_____ m2(选填“>”、“<”或“=”),原因是________________。
(6)取25.00 mL上述溶液,用滴定的方法测定Na2SO3的纯度。下列试剂可作为标准溶液进行滴定的是________。
a.酸性KMnO4溶液? b.H2O2溶液? c.Br2水? d.FeCl3溶液
Na2SO3固体的纯度可表示为:??(注明你的表达式中所用的有关符号的含义和单位)。
参考答案:(1)电子天平(1分);250 mL的容量瓶(1分);
(2)2Na2SO3+ O2→ 2Na2SO4(1分)。
(3)使SO32-充分转化为气体,使SO42-完全沉淀(2分)静置,在上层清液中再滴入氯化钡溶液,观察是否继续有沉淀生成。(1分)
(4)偏高(1分)
(5)<(1分),方案II中盐酸提供H+,Ba(NO3)2提供NO3- 形成稀HNO3,将一部分SO32-氧化成SO42-,导致BaSO4质量增大(1分)。
(6)a(1分),?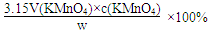 (V—mL,c—mol/L,数学式与答案各1分,2分)。 (V—mL,c—mol/L,数学式与答案各1分,2分)。
本题解析:(1)配制一定体积准确浓度的溶液还少的仪器为电子天平(1分);250 mL的容量瓶(1分);
(2)写出Na2SO3固体氧化变为硫酸钠。
(3)方案I加入过量的盐酸酸化的BaCl2溶液,目的是使SO32-充分转化为气体,使SO42-完全沉淀,在过滤前,需要检验是否沉淀完全,其操作是静置,在上层清液中再滴入氯化钡溶液,观察是否继续有沉淀生成。
(4)方案I中,若滤液浑浊,说明有部分硫酸钡损失了,将导致测定的硫酸钡质量偏低,那么亚硫钠的质量分数偏高。
(5)若操作正确,则m1< m2,原因是方案II中盐酸提供H+,Ba(NO3)2提供NO3- 形成稀HNO3,将一部分SO32-氧化成SO42-,导致BaSO4质量增大。
(6)标准溶液相对性质要稳定,浓度基本保持稳定故 a.酸性KMnO4溶液可行。b.H2O2溶液易分解;c.Br2水易挥发;d.FeCl3溶液会水解,故都不行。根据关系式:2KMnO4------5Na2SO3固体的纯度可表示为: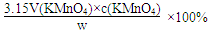 (V—mL,c—mol/L) (V—mL,c—mol/L)
本题难度:一般
5、选择题 设NA为阿伏加德罗常数的数值,下列说法不正确的是(? )
A.常温下,1 L pH=1的硫酸溶液中含有的H+为0.1NA
B.常温下,14g C2H4和C3H6的混合气体中含有2NA个氢原子
C.2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA
D.1mol甲醇中含有C—H键的数目为4NA
参考答案:D
本题解析:A中氢离子的物质的量是0.1mol,A正确。C2H4和C3H6的最简式都是CH2,所以14g混合气中含有2mol氢原子,B正确。钠在反应中只能失去1个电子,C正确。甲醇的结构简式为CH3OH,所以1mol甲醇中含有C—H键的数目为3NA,D不正确,答案选D。
本题难度:一般
|