微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 向NaBr与NaI的混合溶液中通入适量Cl2,反应完全后将溶液蒸干并小心灼烧至恒重,得固体W。
(1)W的可能组成为①____________;②________;③____________;④____________。(填化学式,可以多填或少填)
(2)现将NaBr与NaI的混合固体10.0 g溶于适量水中,通入448 mL Cl2(标准状况)充分反应后,按上述操作得到W的质量为7.28 g。求原混合物中NaI的质量分数。
参考答案:(1)①NaCl?②NaCl、NaBr?③NaCl、NaBr、NaI? (2)30.0%
本题解析:(1)在混合液中通入Cl2,可发生如下反应:
2NaI+Cl2====2NaCl+I2;2NaBr+Cl2====2NaCl+Br2。
因I-比Br-的还原性强,故通入Cl2时,Cl2优先与还原性强的I-反应。灼烧时I2易升华,Br2易挥发。
当Cl2把NaI、NaBr全部氧化时,灼烧至恒重得到NaCl;当Cl2使NaI反应完全而使NaBr未反应或部分反应时,得到的固体为NaCl和NaBr的混合物;当Cl2的量很少,只能使部分NaI氧化时,燃烧所得固体为NaCl、NaBr、NaI三者的混合物。因此,W的组成可能有三种,即①NaCl,②NaCl、NaBr,③NaCl、NaBr、NaI。
(2)n(Cl2)=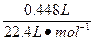 ="0.0200" mol
="0.0200" mol
①若Cl2完全反应,消耗原固体的最大质量为
mmax=m(NaI)=2×0.0200 mol×150 g5mol-1="6.00" g<10.0 g
所以,Cl2的量不足,将完全转化为NaCl。
根据氯元素守恒生成的NaCl应为:
m(NaCl)="0.0200" mol×2×58.5 g·mol-1="2.34" g,所以W中含NaCl 2.34 g。
②如果Cl2 0.0200 mol全部与NaI反应,固体质量减少,
Δm="6.00" g-2.34 g="3.66" g>10.0 g-7.28 g="2.72" g
③若Cl2 0.0200 mol完全与NaBr反应,需NaBr的质量为:
m(NaBr)=2×0.0200 mol×103 g5mol-1="4.12" g
固体质量减少Δm="4.12" g-2.34 g="1.78" g<10.0 g-7.28 g="2.72" g。
由此可推知Cl2与NaI反应完全,而与NaBr部分反应。所以7.28 g固体W为NaCl和NaBr的混合物。
设原固体混合物中NaI的物质的量为x。
Cl2+2NaI====I2+2NaCl?Δm
1 mol? 183 g
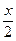
Cl2+2NaBr====Br2+2NaCl?Δm
1 mol? 89 g
0.0200 mol-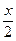
依题意可列方程:
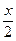 ×183 g·mol-1+(0.0200 mol-
×183 g·mol-1+(0.0200 mol-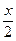 )×89 g·mol-1="10.0" g-7.28 g,解得x="0.0200" mol。
)×89 g·mol-1="10.0" g-7.28 g,解得x="0.0200" mol。
w(NaI)=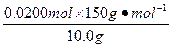 ×100%=30.0%
×100%=30.0%
答:原混合物中的NaI质量分数为30.0%。
本题难度:简单
2、选择题 实验室用MnO2与浓HCl反应制Cl2,若用右图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属镁粉的反应。每个虚线框表示一个单元装置,其中错误的是
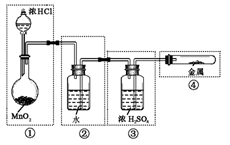
A.只有①和②处
B.只有②处
C.只有①、②和③处
D.①、②、③、④处
参考答案:D
本题解析:①错,二氧化锰与浓HCL反应需要加热;②错,洗气装置的导气管应长进短出;③错,导气管应长进短出;④错,试管口不能用橡皮塞塞紧;
本题难度:简单
3、选择题 新制氯水与久置而完全变质的氯水相比较,下列结论不正确的是( )
A.颜色相同
B.前者能使有色布条褪色,后者不能
C.都含有H+
D.加AgNO3溶液都能生成白色沉淀
参考答案:A.因新制氯水中含氯气,所以新制氯水呈黄绿色,久置氯水中无氯气分子,所以呈现无色,故A错误;
B.新制氯水中含次氯酸,次氯酸具有强氧化性,具有漂白作用,久置氯水中无次氯酸,无漂白作用,故B正确;
C.新制氯水中存在的微粒:三分子:Cl2、HClO、H2O,四离子:H+、Cl-、ClO-、OH-,久置氯水含有H2O、H+、Cl-、OH-,故C正确;
D.新制氯水和久置氯水都含氯离子,加AgNO3溶液都故能生成白色沉淀,故D正确.
故选A.
本题解析:
本题难度:一般
4、选择题 下列叙述中,正确的是( )
A.除去FeCl2溶液中少量的FeBr2,加入适量氯水
B.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
C.将Cl2通入淀粉KI溶液,溶液变蓝
D.在稀硫酸中加入铜粉,铜粉不溶解;再加入KNO3固体,铜粉仍不溶解
参考答案:A.溶液中离子的还原性强弱为Fe2+>Br->Cl-;加入适量氯水会依次反应,溶液中将含有Fe3+和单质溴,引入了新杂质,故A错误;
B.盐酸酸性大于亚硫酸,碳酸,所以将CO2或SO2通入BaCl2溶液中至饱和,都无沉淀产生,故B错误;
C.Cl2能把碘离子氧化为单质碘,单质碘遇到淀粉变蓝,故C正确;
D.铜与稀HNO3反应的离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,可知Cu遇到H+、NO3-能发生氧化还原反应,故D错误;
故选C.
本题解析:
本题难度:一般
5、选择题 下列实验现象和结论一致,正确的是
A.氯水加入有色布条,有色布条褪色,说明溶液中有Cl2存在
B.氯水溶液呈黄绿色,有刺激性气味,说明有Cl2存在
C.氯水加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在
D.氯水加入NaOH溶液,氯水黄绿色消失,说明有HClO存在
参考答案:B
本题解析:氯气没有漂白性,起漂白作用的是氯气和水反应生成的次氯酸,A不正确;氯气是黄绿色具有刺激性气味的气体,则选项B正确;C中由于盐酸中就存在氯离子,所以不能得出氯水中存在氯离子的结论,C不正确;D中,只能说明氯水能和氢氧化钠反应,但不能说明含有次氯酸,D不正确,答案选B。
本题难度:一般