微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列气体有色的是
A.Cl2
B.NO
C.SO2
D.NH3
参考答案:A
本题解析:略
本题难度:一般
2、实验题 甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:

实验中,先用制的的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。

甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。
乙小组测 得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氨气在标准状况下的体积V2L。
请回答下列问题:
(1)写出仪器a的名称?。
(2)检查A装置气密性的操作是?。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
?
| 实验装置
| 实验药品
| 制备原理
|
甲小组
| A
| 氢氧化钙、硫酸、硫酸铵
| 反应的化学方程式为? ①?。
|
乙小组
| ②
| 浓氨水、氢氧化钠
| 用化学平衡原理分析氢氧化钠的作用:? ③?。
|
(4)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为?。
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是?。为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氨气的体积,得出了合理的实验结果。该药品的名称是?。
参考答案:(1)圆底烧瓶(2分)(2)连接导管,将导管插入水中,加热试管,导管口有气泡产生,停止加热,导管内有水回流并形成一段稳定的水柱(3分)(3)①Ca(OH)2+(NH4)2SO4 CaSO4+2NH3↑+ H2O;(2分)②B(2分)氢氧化钠溶于氨水后放热,增加氢氧根浓度,使NH3+H2O
CaSO4+2NH3↑+ H2O;(2分)②B(2分)氢氧化钠溶于氨水后放热,增加氢氧根浓度,使NH3+H2O NH3·H2O
NH3·H2O NH4+ + OH-向逆反应方向移动,加快氨气逸出(2分)(4)5V1:7(m1- m2) (2分)(5)浓硫酸吸收了未参加反应的氨气,从而使计算的氢的量偏高(2分)碱石灰(氯氧化钠、氧化钙等)(2分)。
NH4+ + OH-向逆反应方向移动,加快氨气逸出(2分)(4)5V1:7(m1- m2) (2分)(5)浓硫酸吸收了未参加反应的氨气,从而使计算的氢的量偏高(2分)碱石灰(氯氧化钠、氧化钙等)(2分)。
本题解析:(1)写出仪器a是圆底烧瓶。(2)检查A装置气密性的操作是将导管接入盛水的水槽中,用水握住试管,有气泡产生,放手后能形成一段稳定的水柱,说明气密性良好。(3)①氢氧化钙和硫酸铵共热生成硫酸钙和氨气,方程式为Ca(OH)2+(NH4)2SO4 CaSO4+2NH3↑+ H2O;②乙小组用浓氨水、氢氧化钠固体制备氨气不需加热,故选用B装置。浓氨水中存在NH3+H2O
CaSO4+2NH3↑+ H2O;②乙小组用浓氨水、氢氧化钠固体制备氨气不需加热,故选用B装置。浓氨水中存在NH3+H2O NH3·H2O
NH3·H2O NH4+ + OH-,氢氧化钠固体溶于水,放出大量的热,使NH3的溶解度减小,NH3从氨水中析出,③同时氢氧化钠固体溶于水后发生电离,生成大量OH-,促使上述平衡向左移动,生成更多NH3,从而使NH3从氨水中析出。(4)甲小组2NH3+3CuO
NH4+ + OH-,氢氧化钠固体溶于水,放出大量的热,使NH3的溶解度减小,NH3从氨水中析出,③同时氢氧化钠固体溶于水后发生电离,生成大量OH-,促使上述平衡向左移动,生成更多NH3,从而使NH3从氨水中析出。(4)甲小组2NH3+3CuO 3Cu+N2+3H2O,由此可知,m1- m2为参加反应的CuO中氧的质量,物质的量为(m1- m2)/16,即NH3中H的物质的量为(m1- m2)/8。测的N2在标准状况下体积为V1L,则N原子的物质的量为V1/22.4,则氨分子中氮、氢的原子个数之比为(V1/22.4): (m1- m2)/8,化简得V1/[2.8 (m1- m2)]
3Cu+N2+3H2O,由此可知,m1- m2为参加反应的CuO中氧的质量,物质的量为(m1- m2)/16,即NH3中H的物质的量为(m1- m2)/8。测的N2在标准状况下体积为V1L,则N原子的物质的量为V1/22.4,则氨分子中氮、氢的原子个数之比为(V1/22.4): (m1- m2)/8,化简得V1/[2.8 (m1- m2)]
(5)洗气前装置D前后的质量差包含未参加反应的NH3,使得氢原子的物质的量增大,比值减小。要使没定值准确,只要找一种不吸收NH3的干燥剂即可,故可选用碱石灰。
【考点定位】本题通过NH3和氨气中N、H原子个数测定来考查化学实验基础知识,涉及到仪器的识别、气密性的检查、实验误差解释、相关计算、实验评价及设计。
本题难度:简单
3、选择题 现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图1所示的相互反应,图中每条连线两端的物质可以发生反应。下列判断不合理的是(?)

A.X一定为H2SO4
B.Y一定为K2CO3
C.Z可能为氯水
D.M、N必定各为BaCl2、FeSO4中的一种
参考答案:A
本题解析:能和4种物质发生反应的是Y为K2CO3;能和3种物质发生反应的是BaCl2和FeSO4,;能和2种物质发生反应的H2SO4和氯水,再综合考虑推出可能:
(1)Y:K2CO3?M:BaCl2? N:FeSO4, X:H2SO4 ?Z:氯水
(2)Y:K2CO3 ?N:BaCl2? M:FeSO4, Z:H2SO4?X:氯水
本题难度:简单
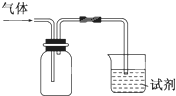
4、选择题 下图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是
?
| 气体
| 试剂
| 现象
| 结论
|
A
| NO
| 紫色石蕊试液
| 溶液变红
| NO与水反应生成硝酸
|
B
| Cl2
| NaBr溶液
| 溶液呈橙黄色
| 氯的非金属性大于溴
|
C
| SO2
| 酸性KMnO4溶液
| 溶液褪色
| SO2有漂白性
|
D
| NH3
| MgCl2溶液
| 产生白色沉淀
| NH3有碱性
|
?
参考答案:B
本题解析:A、NO是无色难溶于水的气体,密度比空气略大,且易与空气中的氧气反应,所以,不能用如图所示的向上排空气法收集,只能用排水法,NO不与水反应,所以不与紫色石蕊试液作用显红色,故A错误;B、氯气是密度比空气大的气体,所以能用如图所示的向上排空气法收集,氯气能将溴单质从其盐中置换出来,Cl2+2Br-═Br2+2Cl-,所以氯气和溴化钠反应生成溴单质,可以看到无色溶液逐渐变为黄,溶液呈橙黄色,根据氧化还原反应中氧化剂的氧化性大于氧化产物,说明氯气的氧化性强于溴,故B正确;C、SO2是密度比空气大的气体,所以能用如图所示的向上排空气法收集,但SO2中+4价S具有还原性,与酸性KMnO4溶液发生2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4反应,导致酸性KMnO4溶液褪色,故C错误;D、NH3密度比空气小,不能用如图所示的向上排空气法收集,氨气在水中存在平衡:NH3+H2O NH3?H2O
NH3?H2O NH4++OH-,在MgCl2溶液中产生白色沉淀为氢氧化镁,不是氨气有碱性,而是氨气与水反应产生碱,氨气是碱性气体,故D错误,答案选B。2和NH3的收集、性质检验等
NH4++OH-,在MgCl2溶液中产生白色沉淀为氢氧化镁,不是氨气有碱性,而是氨气与水反应产生碱,氨气是碱性气体,故D错误,答案选B。2和NH3的收集、性质检验等
本题难度:一般
5、实验题 (9分) 甲酸(HCOOH)是一种有刺激臭味的无色液体,有很强的腐蚀性。熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解成二氧化碳和氢气。
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳:HCOOH浓硫酸========H2O+CO↑,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃—90℃,再逐滴滴入甲酸。
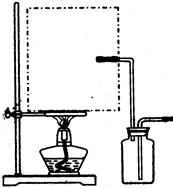
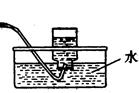
Ⅰ制备CO? Ⅱ? Ⅲ收集CO
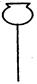
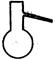
①从下图挑选所需的仪器,画出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。(2分)
 ?
? ?
? ?
? ?
?
分液漏斗?长颈漏斗?蒸馏烧瓶?集气瓶?温度计
② 装置Ⅱ的作用是?。(2分)
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸反应制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
2CuSO4+4 NaHCO3= Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2·CuCO3+4HCOOH+ 5H2O="2" Cu(HCOO)2·4H2O+ CO2↑
实验步骤如下:
Ⅰ、碱式碳酸铜的制备:
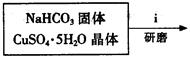


③步骤ⅰ是将一定量CuSO4·5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是?。(2分)
④步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到?(填写实验现象),说明温度过高。(1分)
Ⅱ、甲酸铜的制备:
将Cu(OH)2·CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的1/3时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2—3次,晾干,得到产品。
⑤“趁热过滤”中,必须“趁热”的原因是?。(1分)
⑥用乙醇洗涤晶体的目的是?。(1分)
参考答案:①用分液漏斗、蒸馏烧瓶、温度计,分液漏斗中盛装甲酸,蒸馏烧瓶中盛装浓硫酸,温度计的水银球应浸入浓硫酸中【仪器选择正确并标识液体,注意温度计水银球的位置】(2分)
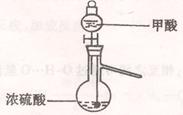
②防止水槽中的水因倒吸流入蒸馏烧瓶中(2分)
③研细并混合均匀(1分)
④出现黑色固体(1分)
⑤防止甲酸铜晶体析出(2分)
⑥洗去晶体表面的水和其它杂质(1分)
本题解析:①因为是给液体加热制备气体,且要控制温度,故气体发生装置与实验室制乙烯的发生装置一样,即如上图所示;②因为是用排水法收集气体,故如果受热不均匀就有可能发生倒吸,故Ⅱ为防倒吸装置;③因为是取混和固体多次加入热水中,故两种固体要混合均匀,而NaHCO3固体和CuSO4·H2O晶体均易结成块,故要研细才可混和均匀;④氢氧化铜和碳酸铜受热均不稳定易分解,前者生成黑色的氧化铜和水,后者者黑色的氧化铜和二氧化碳,所以温度过高会使它们分解,出现黑色固体;⑤蒸发浓缩后甲酸铜的浓度比较高,如果冷却至常温会以晶体的形式析出,故要“趁热”过滤;⑥将滤液冷却结晶后,析出的晶体表面一定会残留有溶液中的其它物质,如表面上有水,还有一些其它的溶质都有可能残留在上面,故用乙醇洗涤晶体的目的是洗去晶体表面的水和其它杂质。用乙醇可减少晶体的损失。
本题难度:简单