微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关实验原理或实验操作正确的是
A.用水湿润pH试纸测量某溶液的pH
B.用量筒量取20mol ?L-1H2SO4溶液于烧杯中,加水80mL,配制成0.1000 mol?L-1H2SO4溶液
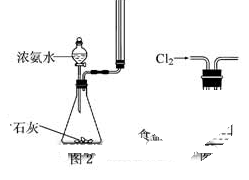
C.实验室用图2所示装置制取少量氨气
D.实验室用图3所示装置出去Cl2中的少量HCl
参考答案:D
本题解析:
答案:D
【分析】本题属于基础实验与基本实验操作的考查范畴。
A.pH试纸用水湿润将冲稀待测溶液。
B.0.5000 mol·L-1 H2SO4溶液与水混合,混合溶液的体积不是两者的简单之和。
C.收集试管带塞子将无法收集到氨气。
D.根据溶解平衡原理,Cl2在饱和食盐水溶解度很小,而HCl极易溶解。
本题难度:一般
2、实验题 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下?
 ?
?
根据要求填空:?
(1) B装置有三种功能:①_________________;②____________;③
________________________。?
(2) 设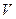 ?(Cl2)/
?(Cl2)/ 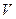 ?(CH4) =
?(CH4) = ,若理论上欲获得最多的氯化氢,则
,若理论上欲获得最多的氯化氢,则 值的取值范围为___________。?
值的取值范围为___________。?
(3) D装置的石棉中均匀混有KI粉末,其作用是___________________。?
(4)E装置的作用是_______________(填编号)。?
A.收集气体? B.吸收氯气?
C.防止倒吸? D.吸收氯化氢?
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。?
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 。?
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为 (填编号)。?
A.CH4?B.CH3Cl?
C.CH2Cl2?D.CHCl3?
E.CCl4?
参考答案:(1)①控制气流速度 ②均匀混合气体 ③干燥混合气体?
(2) 大于或等于4?
(3) 吸收过量的氯气?
(4)CD?
(5) CH4+2Cl2 C+4HCl?(6) 分液 ab?
C+4HCl?(6) 分液 ab?
本题解析:A装置为制取氯气的发生装置,B装置可以除去水蒸气,可以混合甲烷和氯气,同时还可以通过产生气泡的快慢调节气体的流速;由于上述过程中产生的氯气和HCl均易导致大气污染,所以E的作用是吸收尾气;根据甲烷与氯气的反应可知欲获得较多的HCl,也就是使甲烷中的氢原子全部转化为HCl,此时消耗的氯气的物质的量至少是甲烷物质的量的4倍。?
本题难度:简单
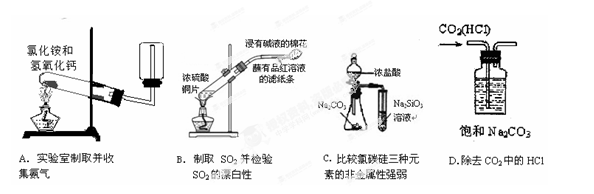
3、选择题 下列实验中,能够达到实验目的的是
参考答案:B
本题解析:A氨气密度比空气小,应该用向下排空气法收集,错误。B制取、性质检验合理,正确。C这是比较酸性HCl>H2CO3>H2SiO3.DHCl和碳酸钠反应生成氯化钠、水、二氧化碳,而二氧化碳遇饱和碳酸钠溶液会发生反应生成碳酸氢钠,二者都反应了。错误。
本题难度:一般
4、选择题 用下列实验装置完成对应的实验,能达到实验目的是( )
A.
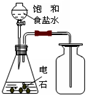
制取并收集乙炔
B.
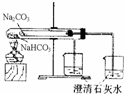
比较NaHCO3、Na2CO3对热稳定性
C.
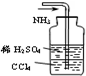
吸收多余的NH3
D.
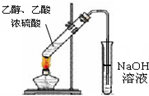
实验室中制取少量乙酸乙酯
参考答案:A、乙炔的相对分子质量是26,空气的是29,所以乙炔的密度小于空气的密度,且乙炔和氧气在常温条件下不反应,所以乙炔应该用向下排空气法收集,故A错误.
B、该装置中加热碳酸氢钠的温度大于碳酸钠的温度,所以不能证明碳酸钠的稳定性比碳酸氢钠的强,应该碳酸钠放置在大试管中,碳酸氢钠放置在小试管中,加热后,温度低的碳酸氢钠能分解生成二氧化碳,而碳酸钠不分解,故B错误.
C、氨气极易溶于水和酸性溶液,四氯化碳的密度大于水的密度且和水、硫酸不反应,所以和稀硫酸混合后分层且处于下层,四氯化碳和氨气不反应,所以四氯化碳有缓冲作用,且稀硫酸能吸收氨气,所以该装置能达到实验目的,故C正确.
D、实验室中制取少量乙酸乙酯时,右边试管中应该用饱和碳酸钠溶液而不是氢氧化钠溶液,且导气管不能伸入溶液中,故D错误.
故选C.
本题解析:
本题难度:简单
5、实验题 氨气具有广泛的用途。
(1)工业上合成氨反应的化学方程式是?。
(2)实验室常用如下图所示装置制取并收集氨气。
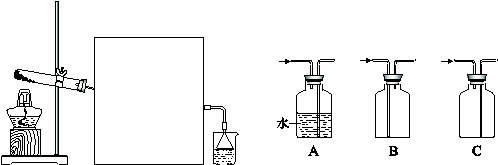
①实验室制取氨气反应的化学方程式是?。
②图中方框内收集氨气的装置可选用?(填字母序号)。
③尾气处理装置中使用倒扣漏斗的作用是?。
(3)工业上用NH3制取NO反应的化学方程式是?。
参考答案:(1)N2+3H2 ?2NH3
?2NH3
(2)①2NH4Cl+Ca(OH)2 ?CaCl2+2NH3↑+2H2O?②C?③防止烧杯中的水倒吸
?CaCl2+2NH3↑+2H2O?②C?③防止烧杯中的水倒吸
(3)4 NH3+ 5O2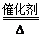 4NO+6H2O
4NO+6H2O
本题解析:(1)在工业上合成氨气的化学反应方程式为N2+3H2 ?2NH3(2)①实验室制取氨气反应的化学方程式是2NH4Cl+Ca(OH)2
?2NH3(2)①实验室制取氨气反应的化学方程式是2NH4Cl+Ca(OH)2 ?CaCl2+2NH3↑+2H2O,②由于氨气极易溶解于水,所以不能用排水法收集,氨气的密度比空气小,所以可用向下排空气法来收集,选项装置为C。③氨气极易溶解于水,导致导气管内的压强减小,烧杯中的水在大气压强的作用下,被压入导气管,最后进入到收集装置。所以尾气处理装置中使用倒扣漏斗的作用是防止烧杯中的水倒吸。(3)工业上用NH3制取NO反应的化学方程式是4 NH3+ 5O2
?CaCl2+2NH3↑+2H2O,②由于氨气极易溶解于水,所以不能用排水法收集,氨气的密度比空气小,所以可用向下排空气法来收集,选项装置为C。③氨气极易溶解于水,导致导气管内的压强减小,烧杯中的水在大气压强的作用下,被压入导气管,最后进入到收集装置。所以尾气处理装置中使用倒扣漏斗的作用是防止烧杯中的水倒吸。(3)工业上用NH3制取NO反应的化学方程式是4 NH3+ 5O2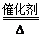 4NO+6H2O。这种方法叫氨气的催化氧化法。3的工业制法、实验室制法、收集、尾气处理及用途。
4NO+6H2O。这种方法叫氨气的催化氧化法。3的工业制法、实验室制法、收集、尾气处理及用途。
本题难度:一般