微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列气体有色的是
A.Cl2
B.NO
C.SO2
D.NH3
2、实验题 甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:

实验中,先用制的的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。

甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氨气在标准状况下的体积V2L。
请回答下列问题:
(1)写出仪器a的名称?。
(2)检查A装置气密性的操作是?。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
?
| 实验装置
| 实验药品
| 制备原理
|
甲小组
| A
| 氢氧化钙、硫酸、硫酸铵
| 反应的化学方程式为? ①?。
|
乙小组
| ②
| 浓氨水、氢氧化钠
| 用化学平衡原理分析氢氧化钠的作用:? ③?。
|
(4)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为?。
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是?。为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氨气的体积,得出了合理的实验结果。该药品的名称是?。
3、选择题 现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图1所示的相互反应,图中每条连线两端的物质可以发生反应。下列判断不合理的是(?)

A.X一定为H2SO4
B.Y一定为K2CO3
C.Z可能为氯水
D.M、N必定各为BaCl2、FeSO4中的一种
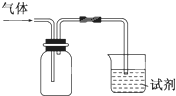
4、选择题 下图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是
?
| 气体
| 试剂
| 现象
| 结论
|
A
| NO
| 紫色石蕊试液
| 溶液变红
| NO与水反应生成硝酸
|
B
| Cl2
| NaBr溶液
| 溶液呈橙黄色
| 氯的非金属性大于溴
|
C
| SO2
| 酸性KMnO4溶液
| 溶液褪色
| SO2有漂白性
|
D
| NH3
| MgCl2溶液
| 产生白色沉淀
| NH3有碱性
|
?
5、实验题 (9分) 甲酸(HCOOH)是一种有刺激臭味的无色液体,有很强的腐蚀性。熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解成二氧化碳和氢气。
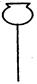
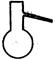
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳:HCOOH浓硫酸========H2O+CO↑,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃—90℃,再逐滴滴入甲酸。
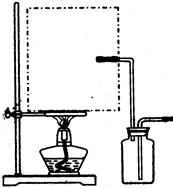
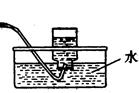
Ⅰ制备CO? Ⅱ? Ⅲ收集CO
①从下图挑选所需的仪器,画出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。(2分)
 ?
? ?
? ?
? ?
?
分液漏斗?长颈漏斗?蒸馏烧瓶?集气瓶?温度计
② 装置Ⅱ的作用是?。(2分)
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸反应制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
2CuSO4+4 NaHCO3= Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2·CuCO3+4HCOOH+ 5H2O="2" Cu(HCOO)2·4H2O+ CO2↑
实验步骤如下:
Ⅰ、碱式碳酸铜的制备:
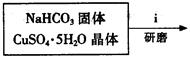


③步骤ⅰ是将一定量CuSO4·5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是?。(2分)
④步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到?(填写实验现象),说明温度过高。(1分)
Ⅱ、甲酸铜的制备:
将Cu(OH)2·CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的1/3时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2—3次,晾干,得到产品。
⑤“趁热过滤”中,必须“趁热”的原因是?。(1分)
⑥用乙醇洗涤晶体的目的是?。(1分)