微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 铝作为材料金属在现代社会中发挥着巨大的作用,铝的化合物在工农业生产及人们的日常生活中也具有广泛地作用。
(1)若将铝溶解,下列试剂中最好选用________(填编号)。
A.浓硫酸? B.稀硫酸? C.稀硝酸
(2)工业制备金属铝利用含有杂质氧化铁和二氧化硅的铝土矿(主要成分为氧化铝)为原料,先制备Al(OH)3。方法是先在铝土矿中加入硫酸,过滤,然后在滤液中加入过量的NaOH溶液,再过滤,在滤液中通入________(一种过量的气体),该反应的离子方程式_______________________________________________。
(3)工业上用电解熔融Al2O3的方法制备金属铝,其阴极反应式为_________。
(4)我国首创以铝、空气、海水为能源的新型电池。该电池以取之不尽的海水为电解液,靠空气中的氧气使铝不断氧化而产生电流。这种海水电池的能量比“干电池”高20~50倍。该新型电池用于航海标志灯已研制成功,只要把灯放入海水中数秒钟,就会发出耀眼的白光。该电池的总反应为:4Al+3O2+6H2O===4Al(OH)3。其负极材料为________,正极反应式为_________________。
(5)碱式氯化铝(分子式可表示为Al2(OH)nCl(6-n)是一种新型无机混凝剂,该产品对工业污水、造纸水、印染水具有较好的净化效果。为确定碱式氯化铝分子式中的n值,可采用沉淀称量法。准确称取碱式氯化铝样品4.97 g,配制成500 mL溶液,用硝酸酸化后,然后逐滴加入过量的AgNO3溶液。然后对沉淀进行过滤、洗涤、干燥,称取沉淀物质量为14.35 g。该碱式氯化铝中的n=________。
参考答案:(1)B
(2)CO2 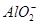 +CO2+2H2O===Al(OH)3↓+
+CO2+2H2O===Al(OH)3↓+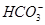
(3)Al3++3e-==="Al"
(4)铝 3O2+ 6H2O +12e-=== 12OH-
(5)1
本题解析:(1)铝与浓硫酸在常温下发生钝化,加热溶解会产生有毒气体SO2,原料利用率低;稀硝酸能溶解铝但会产生NO气体,污染空气,硝酸利用率低;而铝与稀硫酸反应速率较快,产生的H2对空气无污染。(2)铝土矿中加入硫酸,过滤后的滤液中含有Al3+、Fe3+,加入过量NaOH溶液,前者可转化为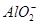 ,后者转化为Fe(OH)3沉淀,再过滤后的滤液中含有NaAlO2溶液,通入过量二氧化碳,转化为Al(OH)3。(3)电解熔融氧化铝时,阳极O2-失去电子生成O2,阴极Al3+得电子生成单质Al。(4)这种新型电池以Al为负极,发生的反应为4Al-12e-===4Al3+,空气中的氧气为正极,发生的反应为3O2+ 6H2O +12e-===12OH-。(5)根据题目提供的数据,利用Cl元素守恒可列等式:
,后者转化为Fe(OH)3沉淀,再过滤后的滤液中含有NaAlO2溶液,通入过量二氧化碳,转化为Al(OH)3。(3)电解熔融氧化铝时,阳极O2-失去电子生成O2,阴极Al3+得电子生成单质Al。(4)这种新型电池以Al为负极,发生的反应为4Al-12e-===4Al3+,空气中的氧气为正极,发生的反应为3O2+ 6H2O +12e-===12OH-。(5)根据题目提供的数据,利用Cl元素守恒可列等式:
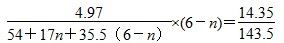
解得n=1。
本题难度:一般
2、选择题 下列只与铝反应,但不与镁反应的物质是( )
A.稀硫酸
B.烧碱溶液
C.氧气
D.氯气
参考答案:Al、Mg为活泼金属,可与氧气、氯气反应,二者都可与稀硫酸反应,但Al既可与酸反应,又可与碱反应,但Mg与碱不反应,只能与酸反应.
故选B.
本题解析:
本题难度:简单
3、选择题 实验室中要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜用的试剂是
A.NaOH溶液
B.Ba(OH)2溶液
C.盐酸
D.氨水
参考答案:D
本题解析:A、B项:都是强碱溶液,碱少量Al3+会剩余一部分留在溶液中,过量Al3+会转化为AlO2-在溶液中,所以在使用的多少的问题上无法确定,故错。C项:盐酸不与Al3+反应,故错。D项:加入氨水使Al3+转化为Al(OH)3沉淀,即使氨水过量沉淀也不溶解,故对。故选D。
点评:本题看的是铝离子(Al3+)与碱溶液的反应,学生要注意的是,在往含有氯离子(Al3+)的溶液中滴加强碱,现象为先有沉淀,后沉淀消失;若滴加弱碱氨水,则生成沉淀但不溶解。
本题难度:一般
4、选择题 不能用NaOH溶液除去括号中杂质的是
A.Mg(Al2O3)
B.MgCl2(AlCl3)
C.Fe(Al)
D.Fe2O3(Al2O3)
参考答案:B
本题解析:A、Al2O3可以和NaOH反应,而Mg不反应,正确;B、,加入NaOH既能和MgCl2反应,又能和AlCl3反应,不能用来除杂,错误;C、铝能溶于NaOH,而镁不行,正确;D、Al2O3可以和NaOH反应,而Fe2O3不反应,可以除杂,正确。
本题难度:一般
5、选择题 有NaCl、MgCl2、FeCl2、FeCl3和AlCl3五种溶液,如用化学方法进行鉴别,只用一种试剂即可将它们鉴别开来,这种试剂是(? )
A.盐酸
B.NaOH溶液
C.氨水
D.AgNO3溶液
参考答案:B
本题解析:盐酸加入上述五种溶液中,均无明显现象;AgNO3溶液加入上述五种溶液中,均生成白色沉淀,故A、D两项不行。NaOH溶液加入上述五种溶液中,现象依次为无明显现象、生成白色沉淀、生成白色沉淀且迅速变为灰绿色,最终变为红褐色、生成红褐色沉淀、先生成白色沉淀后溶解,故可以鉴别,B项正确。氨水加入MgCl2和AlCl3溶液中,均生成白色沉淀。C项不行。
本题难度:简单