微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将a g镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L 的氢氧化钠溶液,得到的沉淀量最大,沉淀质量为(a+1.7) g,则下列说法不正确的是:
A.镁铝合金与盐酸反应时转移的电子数为0.1NA
B.x = 2y
C.沉淀的是Mg(OH)2和Al(OH)3的混合物
D.2x = y
参考答案:B
本题解析:a g镁铝合金,反应后变为氢氧化镁、氢氧化铝沉淀质量为(a+1.7) g,增加的质量为1.7g,为氢氧根离子的质量,故n(OH-)=0.1mol,所以,镁铝合金与盐酸反应时转移的电子数为0.1NA,A 正确;
当沉淀量最大时,n(HCl)与n(NaOH)相等,2x = y,故D正确,B 错误。
得到的沉淀量最大时,肯定是Mg(OH)2和Al(OH)3的混合物,C 正确。
本题难度:一般
2、选择题 Mg、Al混合物m g,用足量稀盐酸溶解后,再向溶液中加入过量烧碱,将沉淀过滤、洗涤、灼烧后得白色粉末m g,原混合物中Mg的质量分数为(? )
A.60%
B.50%
C.40%
D.30%
参考答案:A
本题解析:Mg、Al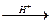 Mg2+、Al3
Mg2+、Al3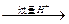 Mg(OH)2、
Mg(OH)2、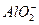 ;沉淀Mg(OH)2
;沉淀Mg(OH)2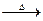 MgO。质量关系:m(Mg)+m(Al)=m(MgO)。故原混合物中Mg的质量分数等于MgO中Mg的质量分数。
MgO。质量关系:m(Mg)+m(Al)=m(MgO)。故原混合物中Mg的质量分数等于MgO中Mg的质量分数。
本题难度:一般
3、选择题 下列物质中,既能跟盐酸反应,又能跟NaOH溶液反应的是( )
A.Mg
B.Al
C.Si
D.Cl2
参考答案:A、Mg与盐酸反应生成氯化镁与氢气,不能与氢氧化钠反应,故A不符合;
B、Al与盐酸反应氯化铝与氢气,与氢氧化钠反应生成偏铝酸钠与氢气,故B符合;
C、Si与氢氧化钠溶液反应生成硅酸钠与水,不与盐酸反应,故C不符合;
D、氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠,不与盐酸反应,故D不符合;
故选B.
本题解析:
本题难度:一般
4、选择题 下列变化不能通过一步实验直接完成的是( )
A.Fe→Fe3O4
B.Fe(OH)3→Fe2O3
C.Al→Al(OH)3
D.Na2O2→Na2CO3
参考答案:A、铁可以与氧气发生反应生成溶液反应生成Fe3O4,能一步实现,故A错误;
? B、氢氧化铁在高温条件下发生分解产生Fe2O3,能一步实现,故B错误;
? C、由铝制备氢氧化铝至少需要两步才能完成,如Al→AlCl3→Al(OH)3,故C正确;?
? D、过氧化钠与二氧化碳反应生成Na2CO3,能一步实现,故D错误;
? 故选:C.
本题解析:
本题难度:简单
5、选择题 工业上焙烧明矾[ KAl(SO4)2·12H2O]的化学方程式为:
4 KAl(SO4)2·12H2O+3S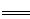 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4
B.最后得到的K2SO4溶液呈中性,所以c(K+)=c(SO42-)
C.焙烧产生的SO2可用于制硫酸,焙烧948 t明矾(M=" 474" g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸432 t
D.工业上冶炼Al2O3制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是
 ?NaAlO2+3Ni(OH)2
?NaAlO2+3Ni(OH)2