微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 化合物甲是由短周期元素组成的陶瓷材料,是一种以共价键相连的物质,具有耐高温、抗冲击、导热性好等优良性质。乙是制备这种材料的起始原料,也是铝土矿的主要成分。制备时采取碳热还原氮化法,即把乙与炭粉按一定比例混合,在流动N2气氛中加热到一定温度即可得到甲和可燃性气体丙,二者原子个数之比均为1:1。8.2g甲与足量的氢氧化钠溶液混合可以得到无色溶液丁,并产生标准状况下4.48L气体戊。
(1)乙的化学式为?,写出它的一种用途?。
(2)甲的晶体类型为?,写出碳热还原氮化法制甲的化学方程式?。
(3)工业制备甲的过程中可能含有的杂质有?。
(4)气体戊的结构式为?,写出甲与足量的氢氧化钠溶液反应的化学方程式为?,验证溶液丁中溶质的实验方法为?。
参考答案:(1)Al2O3?耐高温材料(其他合理均可)?
(2) 原子晶体? Al2O3 + 3C +N2 =2AlN + 3CO?
(3)? Al2O3? C? Al4C3等
(4)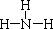 ? AlN + NaOH +H2O=NaAlO2 + NH3?取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2。
? AlN + NaOH +H2O=NaAlO2 + NH3?取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2。
本题解析:
试题分析;据题意可知甲物质为二氧化硅,乙物质为氧化铝。二氧化硅为原子晶体。氧化硅与碳在氮气条件下,高温加热,可生成可燃性气体一氧化碳,。所以Al2O3 + 3C +N2 =2AlN + 3CO?。而AlN + NaOH +H2O=NaAlO2 + NH3。,检验NaAlO2的方法是取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2。主要是利用偏铝酸根离子在酸性条件下可转化为氢氧化铝,而氢氧化铝又溶于强酸的这个性质。
本题难度:一般
2、选择题 下列有关实验的说法正确的是( )
A.除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
B.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
C.制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中
D.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该溶液一定有CO32-
参考答案:A、金属Al既能与酸反应又能与碱反应,而铁不溶于碱,故可用来分离该两种金属,故A正确;
B、瓷坩埚中含有二氧化硅,在加热条件下能与氢氧化钠反应而导致坩埚炸裂,故B错误;
C、制备Fe(OH)3胶体通常的做法是在沸水中滴加饱和的氯化铁溶液,至溶液呈红褐色时停止加热,故C错误;
D、能与盐酸反应产生使澄清石灰水变浑浊的气体的溶液不一定是碳酸盐,也可能为碳酸氢盐溶液或亚硫酸盐溶液,故D错误.
故选A.
本题解析:
本题难度:一般
3、填空题 甲、乙、丙三种物质之间有如下图所示的转化关系,其中甲物质为氧化物:
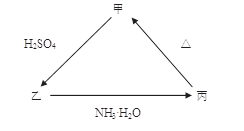
(1)若甲是不溶于水的白色固体,但既能溶于硫酸又能溶于氢氧化钠溶液, 写出下列转化的方程式:
乙 丙的离子方程式______________________; 丙
丙的离子方程式______________________; 丙 甲的化学方程式____________________。
甲的化学方程式____________________。
(2)若向乙溶液中加入KSCN溶液,混合溶液呈红色,则甲物质是________(填化学式)。 甲 乙的离子方程式是_____________________________。
乙的离子方程式是_____________________________。
参考答案:(1)AI3+ + 3NH3 ? H2O = AI(OH)3↓ + 3NH4+?2AI(OH)3 ?AI2O3 + 3H2O
?AI2O3 + 3H2O
(2)Fe2O3? Fe2O3+6H+ =2Fe3+ + 3H2O
本题解析:(1)氧化物甲是不溶于水的白色固体,既能溶于硫酸又能溶于氢氧化钠溶液的是Al2O3.乙是Al2(SO4)3, 丙是Al(OH)3。乙→丙的离子方程式:AI3+ + 3NH3 ? H2O = AI(OH)3↓ + 3NH4+?丙→甲的化学方程式?2AI(OH)3 AI2O3 + 3H2O.(2) 若向乙溶液中加入KSCN溶液,混合溶液呈红色,说明溶液中含有Fe3+,则甲:Fe2O3;乙:Fe2(SO4)3;丙:Fe(OH)3. 甲→乙的离子方程式是Fe2O3+6H+ =2Fe3+ + 3H2O.
AI2O3 + 3H2O.(2) 若向乙溶液中加入KSCN溶液,混合溶液呈红色,说明溶液中含有Fe3+,则甲:Fe2O3;乙:Fe2(SO4)3;丙:Fe(OH)3. 甲→乙的离子方程式是Fe2O3+6H+ =2Fe3+ + 3H2O.
本题难度:一般
4、选择题 科学家成功合成出具有化学特性的氢铝化合物(AlH3)n,最简单的氢铝化合物是Al2H6,它的熔点为150℃,燃烧热极高。下列关于氢铝化合物的推测不正确的是?(?)
A.氢铝化合物与水反应生成氢氧化铝和氢气
B.氢铝化合物中铝显+3价,H显-1价
C.氢铝化合物中不可能存在AlnH2n+2(n为正整数)
D.氢铝化合物具有强还原性
参考答案:C
本题解析:略
本题难度:简单
5、选择题 从海水中提取镁的主要步骤;①把贝壳烧成生石灰;②在海水中加入生石灰,过滤,洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤;④在氯化氢热气流中加热晶体;⑤电解上述所得盐。下列说法不正确的是?(?)
A.上述变化包括了分解反应、化合反应、复分解反应类型
B.贝壳烧成生石灰属于吸热反应
C.在氯化氢热气流中干燥晶体的目的是为了抑制阳离子的水解
D.步骤⑤也可以采用电解该盐水溶液的方法
参考答案:D
本题解析:A项,①是分解反应,②有化合反应(生石灰和水反应)、复分解反应,③是复分解反应,⑤是分解反应,A项正确;B项,贝壳烧成生石灰,也就是碳酸钙受热分解为生石灰和二氧化碳,该反应为吸热反应,B项正确;C项,镁离子容易水解,所以在氯化氢热气流中加热晶体去掉晶体中的结晶水,C项正确;D项参照NaCl水溶液的电解,知道电解氯化镁水溶液得不到单质镁,D项错误。
本题难度:一般