微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)实验室中有甲、乙、丙三位学生做制备氢氧化铝实验,桌上放着同样的药品:231g浓度为70%的硫酸,含杂质苛性钾20%的烧碱140g及足量的铝屑,三位学生分别制得氢氧化铝w1g,w2g,w3g,实验的三种方案示意图如下:
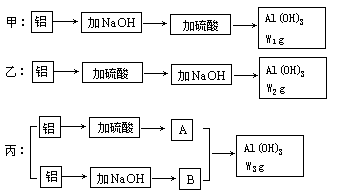
(1)从充分利用原料,降低成本和提高产率等因素分析,哪个学生实验方案最佳(用甲、乙、丙序号表示)__? _____。
(2)三位学生分别制得氢氧化铝质量大小的顺序为(用w1,w2,w3序号表示):___? ____。
参考答案:(1)丙 (2)W3>W1>W2
本题解析:略
本题难度:一般
2、选择题 两份铝屑,一份与过量HCl反应,另一份与过量NaOH溶液反应,产生的H2体积比为1:2,则两份铝屑的质量比为(?)
A.1:2
B.1:1
C.1:3
D.2:1
参考答案:A
本题解析:铝和酸碱反应比值都是2Al-----3H2?,产生的H2体积比为1:2,则两份铝屑的质量比为1:2
本题难度:一般
3、填空题 锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为_______________(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式 ____________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是____________________。(填序号)
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水③ 硫酸锌和氢氧化钠④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式 __________________________。试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因_______________________
参考答案:(1)AlO2-(或Al(OH)4-)
(2)Zn+2NaOH==Na2ZnO2+H2↑ (或Zn+2NaOH+2H2O==Na2Zn(OH)4+H2↑)
(3)①③④
(4)Al3++3NH3·H2O==Al(OH)3↓+3NH4+;可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成Zn(NH3)42+,氨水的用量不易控制
本题解析:
本题难度:一般
4、选择题 下列有关铝的说法正确的是
A.金属铝与盐酸或氢氧化钠溶液分别反应均产生0.2 mol氢气时,失去的电子数不同
B.铝既能与盐酸反应(生成AlCl3),又能与NaOH溶液反应(生成NaAlO2),所以金属铝具有两性
C.金属铝能在空气中形成一层致密的氧化膜,因此是一种比较活泼的金属,所以将少量铝投入到过量的FeCl3溶液中,可以置换出金属铁
D.铝元素在人体内聚集过多,对健康不利,建议尽量少用铝制餐具、铝制食品包装袋、铝制易拉罐等
参考答案:D
本题解析:A项错误,均是铝失电子给H,生成的H2量相同,失电子数相同;B项错误,金属不谈两性,可以说铝是金属,已带有部分非金属性;C项错误,能形成致密的氧化膜与是否是活泼金属无直接关系,少量铝投入FeCl3溶液中先发生反应:Al+3Fe3+===3Fe2++Al3+,Fe3+反应完全后再加入铝,则发生反应:3Fe2++2Al===3Fe+2Al3+。
本题难度:简单
5、填空题 (12分)铝是一种重要的金属,在生产、生活中具有许多重要的用途,右图是从铝土矿中制备铝的工艺流程:
已知:铝土矿的主要成分是Al2O3,此外还含有少量Fe2O3等杂质。
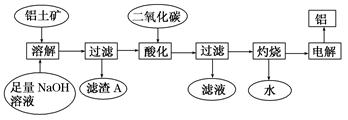
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中铝土矿主要成分发生反应的离子方程式?,滤渣A的主要成分为?。
(2)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是____
__________,通入过量的二氧化碳时,生成沉淀的离子方程式为?_______?。
(3)电解氧化铝,每生成1molAl时,生成??g氧气。
参考答案:(12分)
(1) 2OH—+Al2O3="=" 2AlO2—+H2O;Fe2O3(各2分)
(2)Al(OH)3溶于强酸而不溶于弱酸,提高Al2O3的提取率(或合理答案);(2分)
AlO2— +2H2O+CO2==HCO3— +Al(OH)3↓(3分)
(3)24(3分)
本题解析:(1)铝土矿的主要成分是Al2O3,Al2O3与NaOH反应,生成盐和水,则剩下Fe2O3没有反应,过滤后成为滤渣。(2)Na AlO2酸化之后是“过滤”,即酸化须得沉淀Al(OH)3。Al(OH)3溶于强酸而不溶于弱酸,此题要制备铝,就要提高铝的转化率。所以须用弱酸。过量的二氧化碳反应生成酸式盐。(3)根据电子守恒,生成1molAl,转移3mol电子,同时生成氧气3/4mol,即24克
本题难度:一般