微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题  中的质子数是____________,中子数是____________,核外电子数是____________,质量数是____________。
中的质子数是____________,中子数是____________,核外电子数是____________,质量数是____________。
参考答案:16? 18? 18? 34
本题解析:由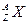 表示的含义知
表示的含义知 中Z=16、A=34,则N=34-16=18。因S2-是得到2个电子的二价阴离子,故核外电子数为16+2=18。
中Z=16、A=34,则N=34-16=18。因S2-是得到2个电子的二价阴离子,故核外电子数为16+2=18。
本题难度:简单
2、选择题 短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素,下列说法正确的是( )
A.原子半径的大小顺序: r(Y)>r(Z)>r(W)
B.元素Z、W的简单离子的电子层结构不同
C.元素Y的简单气态氢化物的热稳定性比Z的强
D.只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物
参考答案:D
本题解析:短周期元素X、Y、Z、W?的原子序数依次增大,Z?是地壳中含量最高的元素,Z为氧元素,X?的原子半径比Y?的小,则X不可能与Y处于同一周期,Y的原子序数小于氧元素,故Y处于第二周期,X处于第一周期,则X为氢元素,X与W同主族,故W为Na元素,四原子最外层电子数之和为13,则Y原子的最外层电子数为13-1-1-6=5,故Y为氮元素。A、同周期自左而右,原子半径减小,同主族自上而下一阵子半径增大,故原子半径Na>N>O,即r(W)>r(Y)>r(Z),错误;B、O2-、Na+离子的核外电子数都是10个电子,核外电子层结构相同,错误;C、同周期自左而右非金属性增强,故非金属性O>N,非金属性越强气态氢化物越稳定,故氢化物稳定性H2O>NH3,错误;D、由H、N、O三元素组成的化合物中,可能是硝酸,为共价化合物,也可能是硝酸铵,为离子化合物,正确。
本题难度:一般
3、填空题 下表为元素周期表的一部分,参照元素①~⑧在表中的位置,用化学用语 回答下列问题:
回答下列问题:

(1)④、⑤、⑦形成的简单离子的半径由大到小的顺序是____________________。
(2)含 ⑦的最高价氧化物对应水化物的稀溶液与足量⑤的最高价氧化物对应水化物的稀溶液反应放出热量
⑦的最高价氧化物对应水化物的稀溶液与足量⑤的最高价氧化物对应水化物的稀溶液反应放出热量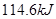 ,此反应的热化学方程式为____________________。
,此反应的热化学方程式为____________________。
(3)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为______________________________。
N ⑥的单质的化学方程式为________________________________________。
⑥的单质的化学方程式为________________________________________。
M溶液中离子浓度由大到小的顺序为________________________________________。
(4)设计实验探究⑧、⑨两种元素非金属性的相对强弱。
可选用的试剂有:氯水、 溶液、
溶液、 溶液、
溶液、 。
。
请完成实验 报告单:
报告单:
实验内容
| 现象
|
步骤一:试管1:取少量氯水:试管2:取少量 溶液,滴加少量氯水。 溶液,滴加少量氯水。
| 试管2中的现象是:____________________
|
步骤二:分别向试管1、试管2中加入试剂________,振荡。
| 试管2中的现象是_________________
|
①试管1的作用是________________________________。
②实验结论是____________________________________________,产生该结论的原因是:同主族元素从上到下________,得电子能力逐渐减弱。
参考答案:(1)
(2)  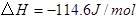
 ?(3) ?(3)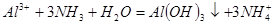
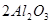  

(4)
?
无色溶液变黄

溶液分层,下层橙色
①对比实验?②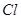 的金属性比 的金属性比 强,原子半径增大 强,原子半径增大
本题解析:略
本题难度:一般
4、填空题 (6分)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
电离能/kJ·mol-1
| I1
| I2
| I3
| I4
| X
| 578
| 1817
| 2745
| 11578
| Y
| 738
| 1451
| 7733
| 10540
| Z
| 496
| 4562
| 6912
| 9543
|
(1)X、Y、Z的最高价氧化物对应的水化物的碱性强弱顺序为?;
(2)X、Y、Z的单核阳离子半径从大到小的顺序为?;
(3)请写出X、Z的最高价氧化物对应的水化物发生反应的离子方程式:
?。
参考答案:(1)NaOH > Mg(OH)2 >Al(OH)3;(2)Na+ > Mg2+> Al3+。
(3)OH-+ Al(OH)3= Al(OH)4-。
本题解析:根据电离能可知X是铝,Y是镁,Z是钠。同周期自左向右原子半径逐渐减小,金属性逐渐减弱。又因为金属性越强,最高价氧化物的水化物的碱性越强,所以碱性强弱顺序为NaOH > Mg(OH)2 >Al(OH)3;核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以离子半径大小顺序是Na+ > Mg2+> Al3+。氢氧化铝是两性氢氧化物,能溶于强健中,方程式为OH-+ Al(OH)3= Al(OH)4-。
本题难度:简单
5、选择题 不能作为元素周期表中元素排列顺序的依据的是?(?)
A.原子的核电荷数
B.原子的核外电子数
C.原子的质子数
D.原子的中子数
参考答案:D
本题解析:略
本题难度:简单
|