微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将50 mL 1.0 mol/LNaCl溶液和50mL,0.5 mol/L CaCl2溶液混合后,若溶液的体积变为二者体积之和,则混合液中Cl-的物质的量浓度为
A.1 mol /L
B.0.55 mol /L
C.0.67 mol /L
D.2 mol /L
参考答案:A
本题解析:前者溶液氯离子物质的量为0.05mol,后者溶液氯离子物质的量为0.05mol,则混合液中Cl-的物质的量为0.1mol,混合后溶液体积为100ml,Cl-的物质的量浓度为1 mol /L
故选A
本题难度:一般
2、选择题 在相同温度下,在体积相同的两个密闭容器内充入等质量的CO2和SO2气体,则下列说法正确的是
A.CO2和SO2中物质的量比为 1:1
B.CO2和SO2的密度比为1:1
C.CO2和SO2的物质的量浓度比为11:16
D.CO2和SO2中所含氧原子个数比为16:11
参考答案:BD
本题解析:等质量的CO2和SO2气体的物质的量之比是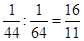 。所以根据阿伏加德罗定律及其推论可知,A不正确,CO2和SO2中物质的量比为 16:11, B正确;C不正确,CO2和SO2的物质的量浓度比为16:11;二者都含有2个氧原子,D正确,答案选BD。
。所以根据阿伏加德罗定律及其推论可知,A不正确,CO2和SO2中物质的量比为 16:11, B正确;C不正确,CO2和SO2的物质的量浓度比为16:11;二者都含有2个氧原子,D正确,答案选BD。
点评:该题是高考中的常见题型和重要的考点,属于中等难度的试题。侧重对基础知识的巩固与检验,有利于培养学生额逻辑推理能力。该类试题相应注意的是在进行物质的量的有关计算时,关键是熟练应用几个关系式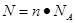 、n=m/M、
、n=m/M、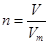 、
、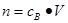 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
本题难度:简单
3、选择题 将乙烷和乙烯的混合气体通过装有溴水的试剂瓶,试剂瓶质量增加了5.6克,则吸收的乙烯在标准状况下的体积是( )
A.2.24L
B.4.48L
C.6.40 L
D.12.8L
参考答案:B
本题解析:乙烯能被溴水吸收,则混合气中乙烯的质量是5.6g,物质的量的是5.6g÷28g/mol=0.2mol,则乙烯在标准状况下的体积是0.2mol×22.4L/mol=4.48L,答案选B。
点评:该题是基础性试题的考查,难度不大。该题的关键是明确和溴水反应的是烯烃,而不是烷烃,然后结合题意直接列式计算即可。
本题难度:一般
4、计算题 (7分)现要配制500mL2.0mol/L的NaOH溶液,请填写下列空白:
(1)若用固体NaOH作溶质,需NaOH的质量为 ,称取这些NaOH常用的仪器有?;
(2)若用10mol/L的NaOH溶液作溶质,需NaOH溶液的体积为?,量取该NaOH溶液常用的的仪器有?;
(3)从上述配制的溶液中取出10mL,其中NaOH的物质的量浓度为?,含有NaOH的质量为?;
(4)将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为?。
参考答案:(1)40g?托盘天平?(2)100mL?量筒?
(3)2.0mol/L? 0.8g?(4)0.2mol/L
本题解析:(1)根据公式:n=cv、n=m/M,可计算m(NaOH)=2mol/L?0.5L?40g/mol=40g,称量固体药品用托盘天平。
(2)此问为稀释计算:根据稀释前后溶质物质的量不变有
10mol/L?V=2mol/L?0.5L? V=0.1L=100ml,
量取液体药品用量筒。
(3)从上述配制的溶液中取出10mL,溶液浓度不变。仍为2mol/L;含有NaOH的质量为2mol/L?0.01L?40g/mol=0.8g。
(4)此问为稀释计算:根据稀释前后溶质物质的量不变有
2mol/L?0.01L=c?0.1L? c=0.2mol/L
点评:此题不难,根据有关公式变化可计算得知。注意考察学生对公式的熟练程度。
本题难度:一般
5、选择题 某溶液中大量存在以下五种离子:NO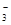 、SO42-、Fe3+、H+、M,其物质的量之比为:n(NO
、SO42-、Fe3+、H+、M,其物质的量之比为:n(NO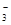 )
)
参考答案:
本题解析:
本题难度:一般