微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 下图是医院病人输液时用的一瓶质量分数为5%的葡萄糖注射液标签,请认真观察标签上的所列内容后填写
?葡萄糖注射液
Glucose Injection
规格:250 mL内含葡萄糖12.5 g
生产批号:0203203? 2
有效期:至2004年3月
配伍:5%
姓名:?床号:?
|
(1)该溶液中含__________________g。
(2)该溶液的密度约为_________________g·mL-1。
(3)该溶液的物质的量浓度__________________。
参考答案:(1)237.5? (2)1? (3)5/18moL-1
本题解析:本题新意在于题干用一标签提供信息,实质考查密度、物质的量浓度、质量分数之间的换算关系。由题意可知:
(1)质量分数=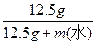 ×100%=5%,所以水的质量为237.5g
×100%=5%,所以水的质量为237.5g
(2)密度=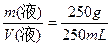 =1 g·mL-1
=1 g·mL-1
(3)c= =5/18mol·L-1
=5/18mol·L-1
本题难度:简单
2、选择题 用NA表示阿伏加德罗常数的值。则下列说法正确的是(?)
A.标准状况下,22.4L己烷中共价键数目为19NA
B.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
C.1cm3铁所含的铁原子数是ρ·NA/56(ρ是铁的密度,单位为g·cm-3)
D.常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
参考答案:C
本题解析:C正确
A.标准状况下,22.4L己烷中共价键数目为19 NA,不正确,己烷在标准状况下是液体。
B.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-,不正确,CO32-要水解。
C.1cm3铁所含的铁原子数是ρ·NA/56(ρ是铁的密度,单位为g·cm-3)
N?(Fe)=n(Fe)×NA =ρg·cm-3×1cm3·NA/56g·mol―1=ρ·NA/56
C正确
D.常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3 NA,不正确,铝在浓H2SO4中钝化。
本题难度:一般
3、选择题 NA表示阿伏加德罗常数,下列叙述中正确的是
A.标准状况下2.24 L三氯甲烷含有分子数目为0.1 NA
B.1mol18O2、16O3混合气体中定含有40NA个质子
C.常温下,100 mL 1 mol·L—1的Na2CO3溶液中的阴离子数目大于0.1NA
D.3.2 g硫与铜充分反应,电子转移总数为0.1NA
参考答案:C
本题解析:A、标准状况下,三氯甲烷是液态,不能适用于气体摩尔体积,A不正确;B、氧气与臭氧都是氧元素形成的不同单质,由于1mol18?O2、16O3混合气体中二者的体积之比不能确定,因此不能确定质子数,B不正确;C、碳酸钠溶于水水解,方程式是CO32-+H2O HCO3-+OH-,即水解过程是阴离子增加的,所以常温下,100 mL 1 mol·L—1的Na2CO3溶液中的阴离子数目大于0.1NA,C正确;D、铜和S反应生成Cu2S,所以3.2 g硫与铜充分反应,转移电子的物质的量是
HCO3-+OH-,即水解过程是阴离子增加的,所以常温下,100 mL 1 mol·L—1的Na2CO3溶液中的阴离子数目大于0.1NA,C正确;D、铜和S反应生成Cu2S,所以3.2 g硫与铜充分反应,转移电子的物质的量是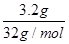 ×2=0.2mol,因此个数为0.2NA,D不正确,答案选C。
×2=0.2mol,因此个数为0.2NA,D不正确,答案选C。
本题难度:一般
4、选择题 设NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA
B.常温常压下,28 g C2H4、CO的混合气体中含有碳原子的数目为1.5NA
C.常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA
D.标准状况下,2.24 L Cl2与足量的NaOH溶液反应,转移的电子数目为0.2NA
参考答案:C
本题解析:A. 标准状况下乙醇是液态,无法计算,错误;B. 常温常压下,28 g C2H4、CO的混合气体中含有碳原子的数目为在NA和1.5NA之间,错误;C.常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA,正确;D. 标准状况下,2.24 L Cl2与足量的NaOH溶液反应,转移的电子数目应为0.1NA,错误;A的运用。
本题难度:一般
5、选择题 标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为cmol/L,则下列关系中不正确的是
A.ρ=
B.ω=
C.ω=
D.c=
E.c=
参考答案:A
本题解析:分析:A、由表达式可知,该密度=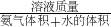 ,溶液体积不等于氨气体积与水的体积之和;
,溶液体积不等于氨气体积与水的体积之和;
B、根据c=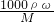 进行计算;
进行计算;
C、根据n= 计算氨气的物质的量,根据m=nM计算氨气的质量,利用m=ρV计算水的质量,根据溶质质量分数=
计算氨气的物质的量,根据m=nM计算氨气的质量,利用m=ρV计算水的质量,根据溶质质量分数= ×100%计算
×100%计算
D、根据c=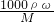 计算.
计算.
解答:A、由表达式可知,该密度=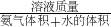 ,溶液体积不等于氨气体积与水的体积之和,故A错误;
,溶液体积不等于氨气体积与水的体积之和,故A错误;
B、由c=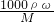 可知,该溶液氨气质量分数ω=
可知,该溶液氨气质量分数ω= ,故B正确;
,故B正确;
C、氨气的物质的量为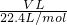 =
=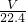 mol,故氨气的质量为
mol,故氨气的质量为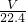 mol×17g/mol=
mol×17g/mol=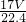 g,1L水的质量为1000g,故该溶液的质量分数为ω=
g,1L水的质量为1000g,故该溶液的质量分数为ω=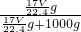 ×100%=
×100%=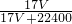 ,故C正确;
,故C正确;
D、由C可知质量分数为ω=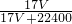 ,故c=
,故c=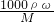 =
=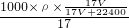 =
=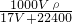 ,故D正确;
,故D正确;
故选A.
点评:考查质量分数、物质的量浓度的有关计算,难度中等,注意公式的理解与灵活运用,题目为字母型计算,计算量较大,需要学生细心观察进行计算.
本题难度:一般