微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氯化银在水中存在溶解平衡:AgCl?Ag++Cl-.在相同温度下,将足量氯化银分别放入相同体积的下列溶液中,Ag+的浓度最小的是( )
A.0.1mol/L?HCl
B.蒸馏水
C.0.1mol/LAlCl3
D.0.1mol/LMgCl2
参考答案:将足量氯化银分别放入相同体积的下列溶液中,Ag+的浓度最小,则Cl-浓度应最大,题中C项Cl-浓度最大,
故选C.
本题解析:
本题难度:简单
2、填空题 (4分)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向
AgCI和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化成黑色固体的化学方程式:? ▲?。
(2)白色固体转化成黑色固体的原因是:? ▲?。
参考答案:

本题解析:略
本题难度:简单
3、选择题 下列说法中正确的是
[? ]
A.物质的溶解性为难溶,则该物质不溶于水
B.不溶于水的物质溶解度为0
C.某离子被沉淀完全是指该离子在溶液中的浓度为0
D.绝对不溶解的物质是不存在的
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列说法错误的是
[? ]
A.铅蓄电池在放电过程中,负极质量最终减小,正极质量最终增加
B.放热反应不一定能自发进行
C.一定条件下,使用催化剂能加快反应速率,但不能提高反应物的平衡转化率
D.温度一定,当溶液中Ag+和Cl-浓渡的乘积等于Ksp时,溶液为AgCl的饱和溶液
参考答案:A
本题解析:
本题难度:一般
5、填空题 运用化学反应原理研究氢、氧、氯、碘等单质及其化合物的反应有重要意义
(1)已知:25℃时KSP(AgCl)=1.6×l0-10?KSP(AgI)=1.5×l0-16
海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在。在25℃下,向0.1L0.002mol·L-l的NaCl溶液中加入0.1L0.002mol·L-l硝酸银溶液,有白色沉淀生成,产生沉淀的原因是(通过计算回答)?,向反应后的浑浊液中继续加入0.1L0.002mol·L-1的NaI溶液,看到的现象是?,产生该现象的原因是(用离子方程式表示)?。
(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是?(填序号)。
A.BaO2 + H2SO4= BaSO4 ↓ + H2O2 ?
B.2NH4HSO4 (NH4)2S2O8 + H2↑
(NH4)2S2O8 + H2↑
(NH4)2S2O8 + 2H2O = 2NH4HSO4 + H2O2
C.CH3CHOHCH3 + O2→ CH3COCH3 + H2O2
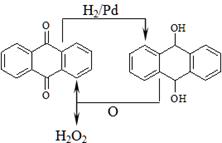
D.乙基蒽醌法见下图
(3)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图1、图2所示。
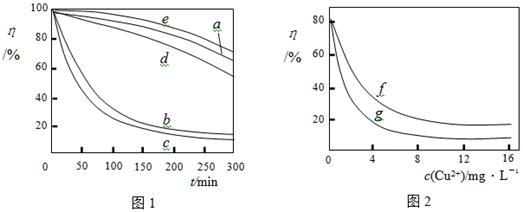
注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg·L―1的条件下进行。图1中曲线a:H2O2;b:H2O2+Cu2+;c:H2O2+Fe2+;d:H2O2+Zn2+;e:H2O2+Mn2+;图2中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关)。
由上述信息可知,下列叙述错误的是?(填序号)。
A.锰离子能使该降解反应速率减缓?
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小
参考答案:(10分)
(1)Q (AgCl)= c(Ag+)·c (Cl-)= 1×l0-6>Ksp(AgCl)?(2分)
白色沉淀转化为黄色沉淀 (2分)
AgCl(s) + I-(aq) ==? AgI(s) + Cl-(aq)? (2分,不标s扣1分,不标aq不扣分)
(2)D(2分)
(3)B(2分)
本题解析:(1)Q (AgCl)= c(Ag+)·c (Cl-)= 1×l0-6>Ksp(AgCl)。KSP(AgI)=1.5×l0-16>Q (AgCl),故白色沉淀转化为黄色沉淀。离子方程式是:AgCl(s) + I-(aq) ==? AgI(s) + Cl-(aq)。
(2)原子利用率最高的是反应物都转化为生成物或有些反应物又重新变为生成物再反应,故错D。
(3)B项:H2O2具有氧化性而Fe2+具有还原性,之间发生了氧化还原反应,故亚铁离子对该降解反应的催化效率比铜离子低说法是错误的。故选B。
点评:本题考查化学平衡、热化学方程式、沉淀转化及读图能力,难度中等,学生注意对基础知识的学习及应用。
本题难度:一般