微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 图1是元素周期表的一部分,所列字母分别代表一种元素:
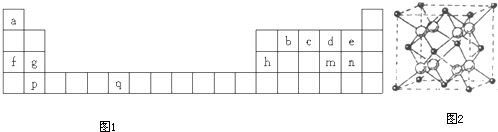
(1)元素q位于周期表中的______区,q原子的外围电子排布式是______.
(2)下列有关说法正确的是______(填字母).
A.b、c、d元素的电负性逐渐增大
B.f、g、h元素的第一电离能逐渐增大
C.md2与bd2的化学性质类似,都是极性分子
D.f、g分别与e组成的物质的晶格能,前者比后者低
E.b2a2分子的立体构型是直线形,该分子中σ键和π键的个数比为3:2
(3)气体md2是一种大气污染物,可被饱和ca3水溶液吸收.试判断md2分子的立体构型是______;指出ca3分子中心原子的杂化方式______.
(4)离子晶体pe2晶胞图2所示,该晶体中e-离子的配位数为______.
参考答案:根据元素在周期表中位置可知,a为H、b为C、c为N,d为O、e为F、f为Na、g为Mg、h为Al、m为S、n为Cl、p为Ca、q为Cr,
(1)元素q处于周期表中第四周期第ⅥB族,为25号Cr元素,常用周期表中d区,外围电子排布式为3d54s1;
故答案为:d,3d54s1;
(2)A.同周期自左而右,元素的电负性增大,故b、c、d元素的电负性逐渐增大,故A正确;
B.同周期自左而右,第一电离能增大,但g为Mg元素,3s能级为全满稳定状态,能量降低,第一电离能高于同周期相邻元素,故大于电离能Mg>Al>Na,故B错误;
C.CO2与SO2都属于酸性氧化物,化学性质具有一定类似性,CO2是直线对称结构,是非极性分子,SO2分子中S元素化合价为+4,S原子最外层6个电子未全部成键,SO2为极性分子,故C错误;
D.离子键强越强,晶格能越高,MgF2中Mg2+的电荷比Na+的多、半径都比NaF中Na+的半径小,故MgF2中离子键更强,晶格能更大,故D正确;
E.C2H2分子的立体构型是直线形,该分子中含有1个C≡C三键,2个C-H,单键为σ键,三键中有1个σ键、2个π键,分子中σ键和π键的个数比为3:2,故E正确;
故选ADE;
(3)SO2分子中S元素化合价为+4,S原子最外层6个电子未全部成键,故SO2分子空间结构为V形;NH3分子中,N原子成3个N-H键,含有1对孤对电子,杂化轨道数目为4,N原子采取sp3杂化;
故答案为:V形,sp3;
(4)由CaF2晶胞结构可知,黑色球数目为6×12+8×18=4,白色球为8,故白色球是F-离子,由晶胞可知,每个F-离子周围有4个Ca2+离子,故F-离子的配位数为4;
故答案为:4.
本题解析:
本题难度:一般
2、选择题 原子核外每个电子层上均含有2n2个电子的元素是
A.Be
B.C
C.Ar
D.Ne
参考答案:D
本题解析:考查原子核外电子的运动规律。A、B的L层不满足8个电子,C中的M层不满足18电子,所以正确的答案是D。
本题难度:简单
3、选择题 下列比较正确的是( )
A.沸点:H2Se>H2S>H2O
B.酸性:HNO3>H3PO4>H2SO4
C.碱性:KOH>NaOH>Mg(OH)2
D.还原性:Cl->Br->I-
参考答案:A、H2Se、H2S、H2O都为分子晶体,其中H2O含有氢键,沸点最高,对于不含氢键的分子晶体来说,分子的相对分子质量越大,分子间作用就越大,沸点越高,所以沸点高低顺序为H2O>H2Se>H2S,故A错误;
B、最高价含氧酸对应非金属元素的非金属性越强,则酸性越强,非金属性,S>P,则酸性H2SO4>H3PO4,故B错误;
C、金属元素的金属性越强,对应最高价氧化物的水化物的碱性就越强,因金属性K>Na>Mg,则碱性KOH>NaOH>Mg(OH)2,故C正确;
D、元素的非金属性越强,则单质的氧化性越强,对应阴离子的还原性就越弱,已知非金属性Cl>Br>I,所以离子的还原性Cl-<Br-<I-,故D错误.
故选C.
本题解析:
本题难度:一般
4、选择题 钠和铯都是碱金属元素,下列关于铯及其化合物的叙述不正确的是
A.少量铯通常可保存在煤油中
B.铯与水反应十分剧烈,甚至会发生爆炸
C.碳酸铯加热时易分解生成二氧化碳和氧化铯
D.氢氧化铯是强碱,碱性比氢氧化钾强
参考答案:C
本题解析:根据碱金属元素性质的相似性,碳酸钠不能分解,所以碳酸铯也不易分解;因为铯的金属性强于钠,所以其与水反应现象更剧烈,生成碱性更强.
本题难度:简单
5、简答题 下表列出了A~R?9种元素在周期表中的位置
| 周期族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
2
E
F
3
A
C
D
G
R
4
B
H
|
用元素符号填写下空:
(1)这9中元素中金属性最强的是______;
(2)化学性质最不活泼的元素是______;
(3)G的最高价含氧酸的化学式是______;
(4)E的最简单氢化物的化学式______;
(5)A在F中燃烧得到产物的化学式______;
(6)C与D的原子半径比较:R(C)______R(D)(填“>”或“<”)
参考答案:根据元素在周期表中的位置可知,A是Na,B是K,C是Mg,D是Al,E是C,F是O,G是Cl,H是Br,R是Ar.
(1)同主族从上到下金属的活泼性逐渐升高,同周期从右到左金属的活泼性逐渐升高,所以最活泼的金属是K.
故答案为:K.
(2)元素周期表中元素活泼性最差的是稀有气体元素,最外层达稳定结构,故Ar活泼性最差.
故答案为:Ar.
(3)G是Cl元素,最高价含氧酸的化学式是HClO4.
故答案为:HClO4.
(4)E是C元素,最简单氢化物的化学式为CH4.
故答案为:CH4.
(5)A是Na元素,F是O元素,A在F中燃烧生成过氧化钠,过氧化钠的化学式为Na2O2.
故答案为:Na2O2.
(6)C是Mg,D是Al,电子层相同的同周期元素的原子从左到右半径逐渐减小,所以原子半径Mg>Al.
故答案为:>.
本题解析:
本题难度:一般