微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)A、B、C、D都是中学化学中的常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。
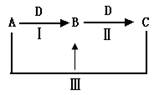
(1)若A是一种强碱,C为厨房中的用品。
①反应Ⅲ的离子方程式是__________________________________。
②下列有关B、C的说法正确的是?
A.向B的饱和溶液中通入D,将有晶体析出
B.可以用BaCl2或CaCl2稀溶液或Ba(OH)2稀溶液鉴别B、C两种溶液
C.分别取等质量的B、C两种固体与足量盐酸反应C产生气体多
D.取a克B、C的混合物充分加热,固体质量减重b克,由此可计算出混合物中B的质量分数
E.取a克B、C的混合物与足量稀硫酸充分反应,逸出的气体用碱石灰完全吸收,增重b克, 由此可计算出混合物中B的质量分数
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅲ的离子方程式是__________________________________。
②向沸水中逐滴加入5~6滴B的饱和溶液,继续煮沸至溶液呈红褐色,该反应的化学方程式为:?。区分该分散系与其它分散系最本质的特征是?。
⑶若常温下A、C是气体,B是固体。
①反应Ⅲ的化学方程式是__________________________________.
有两瓶经过C气体和(2)中的A气体漂白的品红溶液,如何通过简单实验进行鉴别??
?
?。
③在BaCl2溶液中通入C气体,未见沉淀生成,若先通入下列的另一种气体,再通入C;或者向通入C气体的BaCl2溶液中加入下列物质,可以看到沉淀的有_______(填序号)。
A、Cl2? B、NH3? C、HCl? D、CO2?E、KNO3?
参考答案:(16分,每空2分)(1)①HCO3-+OH-="==" H2O+CO32-?②ACD
(2)①Cl2+2Fe2+===2Cl-+2Fe3+? ②FeCl3+3H2O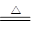 ?Fe(OH)3(胶体)+3HCl
?Fe(OH)3(胶体)+3HCl
分散质微粒直径在1~100 nm之间。
(3)①SO2+2H2S===3S↓+2H2O
②分别取少量经漂白的品红溶液于试管中,加热,恢复红色的是经过C气体漂白的品红溶液,不能恢复红色的是经过(2)中的A气体漂白的品红溶液
③ABE
18、
本题解析:本题为开放性试题,由转化关系,我们很容易想到,①连续氧化、②碱、正盐、酸式盐等。(1)A为强碱,为NaOH、Na2CO3、NaHCO3;(2)D红棕色颜料为Fe2O3,故A:Cl2、D:Fe;(3)C气体漂泊品红,并与Cl2的原理不一样,为SO2,改组为连续氧化得到:H2S→S→SO2。
本题难度:一般
2、选择题 元素A的单质及A与B形成的化合物能按如图所示的关系发生转化。则下列说法正确的是

[? ]
A.图中物质间的转化都不是氧化还原反应
B.当n=1时,A可能是N2
C.A一定是金属元素
D.当n=2时,A可能是Fe
参考答案:D
本题解析:
本题难度:简单
3、填空题 在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).

回答下列问题:
(1)在反应②中,每生成2.24L气体G(标准状况)时,该反应转移电子的物质的量是______.
(2)若反应①在常温下进行,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,则反应①的离子方程式是______.
(3)若反应①在加热条件下进行,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是______.
(4)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸有气体产生,在加热条件下,当A过量时,反应①的离子方程式是______.
(5)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,当A过量时,C及D均易溶于水,则A过量时反应①的离子方程式是______.
参考答案:E为常温下无色无味的液体且在生成物中,所以是水.F为淡黄色粉末,是过氧化钠或硫,但能和水反应,所以是过氧化钠.过氧化钠和水反应的生成物是氧气和氢氧化钠,G为常见的无色气体,所以G是氧气,H是氢氧化钠.
(1)设该反应转移电子的物质的量xmol
2Na2O2+2H2O=4NaOH+O2↑? 转移电子数
? 22.4L? 2mol
?2.24L? x
?x=0.2mol,故答案为:0.2mol;
(2)若反应①在常温下进行,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,A是氯气,与碱反应,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)若反应①在加热条件下进行,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,C、D是二氧化碳和二氧化硫,E为水,所以C、D、E是浓硫酸和碳反应的产物,
故答案为:C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O;
(4)B是一种酸式盐,且B遇盐酸有气体产生,所以B可能是碳酸氢盐或亚硫酸氢盐或硫氢化物.A是一种常见一元强碱,B是一种酸式盐,D是一种气体,强碱与酸式盐反应生成气体,该气体是氨气,所以A、B的反应是强碱和碳酸氢铵或亚硫酸氢铵或硫氢化铵的反应,
故答案为:2OH-+NH4++HCO3-?△?.?NH3↑+2H2O+CO32-(或2OH-+NH4++HSO3-?△?.?NH3↑+2H2O+SO32-2OH-+NH4++HS-?△?.?NH3↑+2H2O+S2-);
(5)B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,所以B是偏铝酸钠,A是一种强酸,酸先和偏氯酸钠反应生成氢氧化铝,氢氧化铝和过量的酸反应生成铝离子,故答案为:AlO2-+4H+=Al3++2H2O.
本题解析:
本题难度:一般
4、填空题 (15分)现有四种元素,分别位于元素周期表的前四个不同周期,其原子序数总和为48.由它们可组成甲、乙、丙、丁四种单质和A、B、C、D四种化合物,其中甲、乙为非金属单质,丙、丁为金属单质.这些物质间的转化关系如下图所示(反应条件已省略)

请回答下列问题:
(1)组成丁的元素在周期表中的位置________________.B的俗名_____________,C物质的用途之一_____________________.
(2)写出A+乙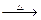 B的化学方程式___________________________________.
B的化学方程式___________________________________.
(3)在加热条件下,丁与气态D可发生反应,该反应的化学方程式为___________.
(4)若21.6g A与适量的乙反应生成B,A、B按上述图示转化为溶液I和溶液II(假设各步反应均恰好进行完全);向溶液I中通入________mol Cl2,经充分反应可恰好使溶质的组成与溶液II完全相同.
参考答案:(15分)(1)第四周期VIII族(2分) 磁性氧化铁(2分)
耐火材料或治炼铝的原料(2分)
(2)6FeO+O2 2Fe3O4(3分)
2Fe3O4(3分)
(3)3Fe+4H2O(g) 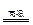 Fe3O4+4H2(3分)
Fe3O4+4H2(3分)
(4)0.1(3分)
本题解析:略
本题难度:一般
5、简答题 X、Y是中学化学里常用的物质,其中Y是单质,X是化合物;它们之间相互反应以及生成物之间的关系如图所示:
已知E溶液跟NH4SCN的稀溶液混合时,溶液呈血红色.请回答:
(1)Y和X浓溶液反应的条件是______,而常温下难反应的原因是______.
(2)写出F和G相互转化的化学方程式:F→G+X______G→F______
(3)L转化成I的现象是______,有关的化学方程式是______.
参考答案:X、Y是中学化学里常用的物质,其中Y是单质,X是化合物;它们之间相互反应以及生成物之间的关系如图所示:已知E溶液跟NH4SCN的稀溶液混合时,溶液呈血红色,说明E含有Fe3+离子,加入氢氧化钠溶液生成氢氧化铁沉淀I为Fe(OH)3,L为Fe(OH)2,H为含Fe2+离子的溶液;K为推断Y为Fe,D为H2O,J为O2,依据Y和X的浓溶液反应生成的F和D反应生成G和X,判断F为NO2,X为HNO3,G为NO,所以推断出E为Fe(NO3)3,H为Fe(NO3)2,依据推断得到的物质分别为:X为HNO3,Y为Fe;D为H2O,Fe(NO3)3,H为Fe(NO3)2,F为NO2,G为NO,J为O2,K为NaNO3,L为
Fe(OH)2,I为Fe(OH)3;
(1)Y和X浓溶液反应的条件是加热,常温下铁在浓硝酸中 发生钝化现象;
故答案为:加热,Fe表面被浓硝酸钝化;
(2)依据分析推断得到F→G+X反应的化学方程式为:3NO2+H2O=2HNO3+NO,G→F反应的化学方程式为:2NO+O2=2NO2
故答案为:3NO2+H2O=2HNO3+NO,2NO+O2=2NO2
(3)L转化成I是氢氧化亚铁被一氧化为氢氧化铁,反应的现象是:白色固体迅速变为灰绿色,最后变为红褐色,有关的化学方程式是?4Fe(OH)2+2H2O+O2=4Fe(OH)3;
故答案为:白色固体迅速变为灰绿色,最后变为红褐色; 4Fe(OH)2+2H2O+O2=4Fe(OH)3;
本题解析:
本题难度:一般