微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 物质A、E、F的焰色反应呈黄色,物质I的分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示:

请填写下列空白:
(1)写出下列物质的化学式:B:______;J:______.
(2)写出下列反应的方程式:①反应①的离子方程式:______;②反应⑤的化学方程式:______.
(3)在通常状况下,若1g?C气体在B气体中燃烧生成H气体时放出92.3kJ热量,则2mol?H气体完全分解生成C气体和B气体的热化学方程式为:______.
参考答案:I的分子由4个原子组成并共含有10个电子,应为NH3,G在常温下是无色液体,应为H2O,由转化关系可知反应⑤应为氨气的催化氧化,则K为O,J为NO,则C为H2,D为N2,物质A、E、F的焰色反应呈黄色,应都含有钠元素,M在光照条件下可生成O2,应为HClO,则H为HCl,B为Cl2,E为NaClO,A为NaOH,F为NaCl,
(1)由以上分析可知B为Cl2,J为NO,故答案为:Cl2;NO;
(2)①反应①为氯气和氢氧化钠的反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
②反应⑤为氨气的催化氧化反应,反应的化学方程式为4NH3+5O2催化剂.△4NO+6H2O,
故答案为:4NH3+5O2催化剂.△4NO+6H2O;
(3)若1g?H2气体在Cl2气体中燃烧生成H气体时放出92.3kJ热量,则1molH2燃烧放出184.6kJ热量,则有2HCl(g)=H2(g)+Cl2(g);△H=+184.6?kJ?mol-1,
故答案为:2HCl(g)=H2(g)+Cl2(g);△H=+184.6?kJ?mol-1.
本题解析:
本题难度:一般
2、推断题 A、B、C、D和甲有以下转化关系。已知物质甲是短周期元素组成的盐,且是某种消毒液的有效成分,沉淀D可溶于酸。
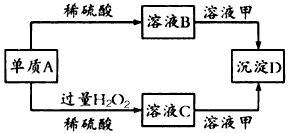
请回答下列问题:
(1)组成A的元素在周期表中位于第____周期第____族。
(2)鉴定C中阳离子(不考虑H+)的操作和现象是___________________
(3)A转化为B时会放出无色气体E,在298 K时1 mol A完 全反应放出热量Q kJ,则该反应的热化学方程式为_______________
(4)若A转化为C时无气体放出,写出该反应的化学方程式:________________________。
(5)写出溶液C和溶液甲反应的离子方程式___________________
参考答案:(1)四;Ⅷ
(2)向少量C溶液中滴入KSCN溶液,溶液显红色,说明C中有Fe3+(其他合理答案均可)
(3)Fe(s)+2H+(aq)=Fe2+(aq)+H2(g);△H= -QkJ/mol
(4)2Fe +3H2O2 +3H2SO4 =Fe2(SO4)3+6H2O
(5)Fe3+ +3ClO- +3H2O =Fe(OH)3↓+3HClO
本题解析:
本题难度:一般
3、填空题 A、B、C、D、E是Na的单质及其化合物,它们有如图所示的相互转化关系.
(1)写出以下物质的化学式:C______;F______
(2)完成以下离子方程式:
C→D:______
D→E:______
(3)等质量的A和B分别投入到等质量且足量的水中,反应后所得溶液溶质质量分数分别为
ω1、ω2,则ω1______ω2(填“>”或“<”或“═”).
(4)E中混有少量的F,用化学方程式表示除去F的两种方法:______、______
(5)用mg的D来制取纯净的E,写出最简单的实验方法______.
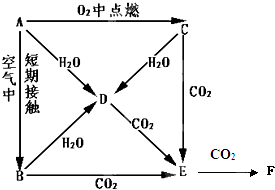
参考答案:A、B、C、D、E是Na的单质及其化合物,由转化关系可知,A为Na,C为Na2O2,B为Na2O,D为NaOH,E为Na2CO3,F为NaHCO3,
(1)由上述分析可知C为Na2O2,F为NaHCO3,故答案为:Na2O2;NaHCO3;
(2)C→D的离子反应为2Na2O2+2H2O=4Na++4OH-+O2↑,D→E的离子反应为2OH-+CO2=CO32-+H2O,故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;2OH-+CO2=CO32-+H2O;
(3)设质量均为46g,水的质量为m,
由2Na+2H2O=2NaOH+H2↑可知,n(NaOH)=2mol,溶液的质量为46+m-2=m+44,由Na2O+H2O=2NaOH可知,n(NaOH)=4631mol,溶液的质量为46+m,钠与水反应生成的溶质的质量较大,则ω1>ω2,故答案为:>;
(4)除去F的方法为NaHCO3+NaOH=Na2CO3+H2O、2NaHCO3△.Na2CO3+CO2↑+H2O,
故答案为:NaHCO3+NaOH=Na2CO3+H2O;
(5)D来制取纯净的E,最简单的实验方法为将mgNaOH固体加一定量的水溶解,制成溶液.再将溶液分为等体积的两份,一份通入足量CO2,充分反应后与另一份溶液混合.最后再将溶液蒸干,
故答案为:将mgNaOH固体加一定量的水溶解,制成溶液.再将溶液分为等体积的两份,一份通入足量CO2,充分反应后与另一份溶液混合.最后再将溶液蒸干.
本题解析:
本题难度:一般
4、简答题 X、Y、Z、W是周期表中原子序数依次增大的前20号元素.X、Y同周期,Y、Z同主族.Zn-与Wn+离子的电子层结构相同.由这四种元素形成的单质、化合物有如图转化关系.已知:常温下A为液体,B、C、E、G为气态化合物,且A、C、G均为直线型分子;D是由元素W、Y形成的常见化合物.
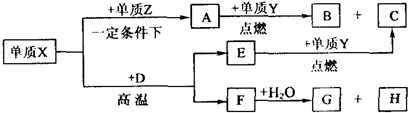
(1)元素W的名称______,Z的原子结构示意图______,A的电子式______.
(2)写出D、E的化学式:D:______、E:______.
(3)①已知38gA与Y完全反应生成B、C时放出akJ的热量,写出该反应的热化学方程式:______.
②F与水反应的化学方程式:______.
参考答案:根据转化关系,单质Y在点燃情况下才能与A、E反应,可猜想单质Y为O2;Y、Z同主族,则Z为S;Zn-与Wn+离子的电子层结构相同,推知W为Ca,D为CaO,与钙元素相关的,反应生成的直线型分子应该为C2H2,推知F为CaC2,H为Ca(OH)2,X为C,C在高温下与CaO反应生成CaC2和CO,推知E为CO,C为CO2,单质C和单质S在一定条件下形成直线型的CS2分子,CS2在O2中燃烧生成SO2和CO2.将所得结论代入题设框图验证可知完全正确.
(1)由上述分析可知,W为钙元素;Z为硫元素,质子数为16,核外电子数为16,有3个电子层,最外层有6个电子,原子结构化示意图为

;CS2的电子式与二氧化碳电子式类似,所以CS2的电子式为
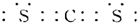
,
故答案为:钙;

;
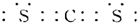
;
(2)由上述分析可知,D为CaO,E为CO,故答案为:CaO;CO;
(3)①38gCS2(l)为0.5mol,与O2(g)完全反应生成CO2(g)和SO2(g),放出a kJ热量,则1 mol CS2(l)与O2(g)完全反应生成CO2(g)和SO2(g)放出2a kJ热量,所以热化学方程式为CS2(l)+3O2(g)═CO2(g)+2SO2(g)△H=-2akJ/mol,
故答案为:CS2(l)+3O2(g)═CO2(g)+2SO2(g)△H=-2akJ/mol;
②碳化钙与水反应生成氢氧化钙与乙炔,反应方程式为CaC2+2H2O→C2H2↑+Ca(OH)2,故答案为:CaC2+2H2O→C2H2↑+Ca(OH)2.
本题解析:
本题难度:一般
5、简答题 A、B、C、D分别代表硝酸银、偏铝酸钠、稀盐酸、浓氨水四种无色溶液中的一种.甲、乙两同学按不同体积比进行了两两混合,实验现象如下:
(1)根据图中A、C各能溶解一种沉淀,可判断A、C两种物质可能是______和______.
(2)结合图中A、B混合无现象,可确定B是______,则A必然是______.
(3)写出A和D按物质的量之比为1:1混合时反应的离子方程式______.
(4)写出B和C按物质的量之比为1:1混合时反应的化学方程式______.
(5)甲同学做B、C反应实验时,n(B)/n(C)应符合的条件是______.
参考答案:题给四种物质中,浓氨水与AgNO3(aq)混合,可能生成沉淀AgOH(会有部分分解为Ag2O),也可能生成无色[Ag(NH3)2]+(aq);NaAlO2(aq)与HCl(aq)混合,可能生成Al(OH)3沉淀,也可能生成无色AlCl3(aq).Al(OH)3沉淀溶于HCl(aq),但不溶于氨水;AgOH(含Ag2O)沉淀溶于氨水,但在HCl(aq)中沉淀并不消失.这样,可知B、D为NaAlO2(aq)和AgNO3(aq),B遇A(氨水或稀盐酸)无现象,则B为NaAlO2,A为氨水,C为稀盐酸,D为AgNO3.
(1)由以上分析可知生成的沉淀可为AgOH、AgCl或Al(OH)3,能溶解AgOH、AgCl的为浓氨水,能溶解的Al(OH)3为盐酸,由转化关系可知A为浓氨水,C为盐酸,
故答案为:浓氨水;盐酸;
(2)由以上分析可知B为NaAlO2,A为浓氨水,故答案为:NaAlO2;浓氨水;
(3)氨水和AgNO3按物质的量之比为1:1混合时反应的离子方程式为Ag++NH3?H2O=Ag0H↓+NH4+,
故答案为:Ag++NH3?H2O=Ag0H↓+NH4+;
(4)NaAlO2和稀盐酸按物质的量之比为1:1混合时反应的化学方程式为NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,
NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
(5)B为NaAlO2,C为稀盐酸,甲同学做B、C反应实验时,没有沉淀生成,发生NaAlO2+4HCl=AlCl3+NaCl+2H2O,则n(B)/n(C)应符合的条件是≤14,
故答案为:≤14.
本题解析:
本题难度:一般