微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 硫代硫酸钠溶液与稀硫酸反应的化学方程式为:
Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O四个试管中都装有5 mL 0.1 mol/L? Na2S2O3溶液,分别在不同温度下加入0.1 mol/L H2SO4和一定量水,最先出现浑浊的是
A.20℃,10 mL H2SO4
B.20℃,5 mL H2SO4,5 mL水
C.30℃,5 mL H2SO4,2 mL水
D.30℃,4 mL H2SO4,3 mL水
2、选择题 少量铁粉与100ml 0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
[? ]
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液
⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10ml0.1mol/L的盐酸
A.①⑥⑦
B.③⑤⑧
C.③⑦⑧
D.③⑥⑦⑧
3、填空题 (15分)研究碳、氮氧化物的性质与利用具有重要意义。
(1)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是 。
②由MgO制成的Mg可构成“镁——次氯酸盐”电池,其装置示意图如图1,该电池的正极反应式为 ;
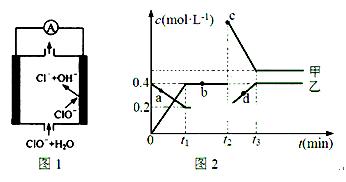
(2)化合物甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图2所示:
①甲的化学式是 ;
②图中a、b、c、d四点中,表示反应处于平衡状态的是 。t1~t2时间内v正(乙) v逆(甲)(填“>”“<”或“=”)
③反应进行到t2时刻,改变的条件可能是 。
(3)用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是 。
4、选择题 已知某可逆反应:mA(g)+nB(g)  pC(g);△H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
pC(g);△H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是

A.T1<T2,P1>P2,m+n>p,△H>0
B.T1>T2,P1<P2,m+n>p,△H>0
C.T1>T2,P1<P2,m+n<p,△H<0
D.T1>T2,P1>P2,m+n>p,△H<0