| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《离子方程式的书写及正误判断》试题特训(2017年最新版)(八)
参考答案:C 本题解析:A、醋酸除去水垢中的CaCO3:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,A错误;B、向NaAlO2溶液中通入过量CO2:AlO2-+ CO2 + 2H2O = A(OH)3↓+ HCO3-,B错误;C、将过量二氧化硫气体入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+,C正确;D、用KIO3氧化酸性溶液中的KI:5I-+IO3-+6H+=3I 2+3H2O,D错误,答案选C。 本题难度:一般 2、填空题 氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作(注意事项:①所加试剂必须过量;②过量试剂必须除去;③不能引入新的杂质)。 参考答案:(1)BaCl2 本题解析:(1)要除掉杂质离子硫酸根离子和碳酸根离子,应加入过量的钡离子,又不能引入其他离子,因此选用BaCl2溶液,与 本题难度:一般 3、填空题 (12分)为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。 参考答案:(1)2Al+2OH—+2H2O=2AlO2-+3H2↑ 本题解析:(1)合金废料含有铝、铁和铜,只有铝与碱反应:2Al+2OH—+2H2O=2AlO2-+3H2↑(2)固体B中含铁和铜,制取绿矾所以用稀硫酸或H2SO4;步骤Ⅰ、Ⅱ、Ⅲ均为固体与液体分离所以需进行的实验操作是过滤。 本题难度:困难 4、填空题 【化学——选修2化学与技术】(15分) |
参考答案:(除注明外,每空2分)(1)①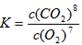 ; ABC(3分); ②NaA1O2[或NaA1(OH)4] Na2SiO3;
; ABC(3分); ②NaA1O2[或NaA1(OH)4] Na2SiO3;
③除去A1O2-、SiO32-等杂质; ④2CrO42-+2H+=Cr2O72-+H2O(2)蒸发;趁热过滤
本题解析:(1)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据步骤I中反应的化学方程式可知该反应的化学平衡常数的表达式为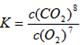 。A.升高温度反应速率加快,A正确;B.通入过量的空气,增大氧气浓度,反应速率加快,B正确;C.将原料粉碎增大反应物的接触面积,反应速率加快;D.纯碱是固体,增加纯碱的用量不能影响反应速率,D错误,答案选ABC。
。A.升高温度反应速率加快,A正确;B.通入过量的空气,增大氧气浓度,反应速率加快,B正确;C.将原料粉碎增大反应物的接触面积,反应速率加快;D.纯碱是固体,增加纯碱的用量不能影响反应速率,D错误,答案选ABC。
②由于溶液显碱性,单质铝与硅均能与氢氧化钠溶液反应,则在碱性溶液中铝和硅的存在形式分别是NaA1O2[或NaA1(OH)4]、Na2SiO3;
③由于溶液中含有偏铝酸钠和硅酸钠等杂质,因此步骤III需将溶液的pH调至7~8并煮沸的目的是除去A1O2-、SiO32-等杂质,以得到纯净的铬酸钠溶液。
④加入硫酸后有重铬酸钠和硫酸钠生成,则步骤Ⅳ中发生反应的离子方程式为2CrO42-+2H+=Cr2O72-+H2O。
(2)由于NaCl的溶解度受温度影响小,而K2Cr2O7的溶解度受温度影响大,因此可以利用结晶法除去氯化钠,即基本实验步骤为:①溶解;②蒸发;;③趁热过滤;④冷却、结晶,过滤,得到K2Cr2O7晶体。
考点:考查物质制备工艺流程图的有关分析与判断
本题难度:困难
5、填空题 (8分)现有四瓶贴有A、B、C、D标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液。现进行如下实验,并记录部分现象(如下图)。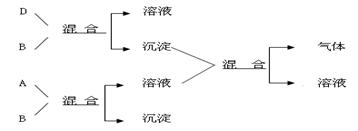
判断A是 (写化学式,下同),B是 ,C是 ,D是 。
B和D反应的离子方程式是
A和B反应的离子方程式 。
参考答案:NaHSO4 Ba(NO3)2 K2SO4 K2CO3 Ba2++CO32-=BaCO3↓ Ba2++SO42-=BaSO4↓
本题解析: B能与A或D反应生成沉淀,说明B是硝酸钡,沉淀为碳酸钡和硫酸钡,而B和D生成的沉淀可以与溶液反应生成气体,说明沉淀为碳酸钡,故D为碳酸钾。碳酸钡沉淀溶于酸,所以A和B反应后生成了酸,故A为硫酸氢钠,C为硫酸钾。B和D反应是硝酸钡和碳酸钾反应色生成碳酸钡沉淀和硝酸钾,故离子方程式写成;Ba2++CO32-=BaCO3↓;A和B反应是硫酸氢钠和硝酸钡反应生成了硫酸钡沉淀和硝酸和硝酸钠,故离子方程式写成:Ba2++SO42-=BaSO4↓。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《电解质溶液.. | |