微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (11分)(1)在Na+浓度为0.9mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
阳离子
| K+、Ag+、Mg2+、Ba2+
|
阴离子
| NO3-、CO32-、SiO32-、SO42-
|
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
序号
| 实验内容
| 实验结果
|
Ⅰ
| 向该溶液中加入足量稀HCl
| 产生白色沉淀并放出1.12L气体
|
Ⅱ
| 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量
| 固体质量为3.6g
|
Ⅲ
| 在Ⅱ的滤液中滴加BaC12溶液
| 无明显现象
|
试回答下列问题:(1)实验I能确定一定不存在的离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
阴离子
| NO3-
| CO32-
| SiO32-
| SO42-
|
c/mol·L-1
|
|
|
|
|
(4)判断K+是否存在,若存在求其最小浓度_______,若不存在说明理由________ 。
(5)Ⅰ、溴被称为海洋元素,向盐卤中通入氯气可制得溴:Cl2 + 2NaBr =" 2NaCl" + Br2,该反应被氧化的元素为 (写元素符号);若上述反应制得16g Br2 ,则转移的电子数目是 个。
Ⅱ、请按要求书写化学方程式或离子方程式。
(1)小明运用化学实验证明了久置于空气中的亚硫酸钠已变质,请用化学方程式表示亚硫酸钠变质的原因 。
(2)FeSO4溶液用稀H2SO4酸化,放置一段时间后略显黄色,写出变化过程的离子方程式 ;然后向其中滴加KI-淀粉溶液变蓝色,写出变化过程的离子方程式 _。
参考答案:(1)Ag+、Mg2+、Ba2+(3分);
(2)SiO32- + 2H+ ="==" H2SiO3↓(或SiO32-+ 2H+ + H2O ="==" H4SiO4↓)(2分)
(3)(4分)
阴离子
NO3-
CO32-
SiO32-
SO42-
c/mol/L
?
0.5
0.6
0
(4)存在,其最小浓度为1.3mol/L (3分)
(5)Ⅰ.Br 、0.2NA;Ⅱ. (1)2Na2SO3+O2=2Na2SO4,
(2)4Fe2++4H++O2=4Fe3++2H2O;2Fe3++ 2I-= 2Fe2++ I2。
本题解析:(1)向该溶液中加入足量稀HCl,产生白色沉淀并放出1.12L气体,则含有CO32-,由于CO32-与Ag+、Mg2+、Ba2+会发生沉淀反应而不能大量共存,所以一定不存在离子Ag+、Mg2+、Ba2+,(2)与HCl发生反应形成白色沉淀的离子是SiO32-,产生的沉淀是H2SiO3;离子方程式是:2H++SiO32-=H2SiO3↓;(或SiO32-+ 2H+ + H2O ="==" H4SiO4↓);(3)将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重固体是SiO2,称量所得固体质量,固体质量为3.6g则n(SiO2)= 3.6g÷60g/mol=0.06mol,c(SiO32-)=0.06mol÷0.1L=0.6mol/L,n(CO2)=n(CO32-)=1.12L÷22.4L/mol=0.05mol;c(CO32-)=0.05mol÷0.1L="0." 5mol/L,在Ⅱ的滤液中滴加BaC12溶液, 无明显现象,证明不含SO42-;(4)溶液呈电中性。c(Na+)=0.9mol/L,c(CO32-)="0." 5mol/L根据电荷守恒,2c(CO32-)+ 2c(SiO32-)= 2.2mol/L> c(Na+)=0.9mol/L,故溶液中一定有K+。由于NO3-不确定,则c(K+)≥1.3mol/L。(5)Ⅰ向盐卤中通入氯气可制得溴:Cl2 + 2NaBr =" 2NaCl" + Br2,在该反应NaBr中的Br元素的化合价升高,失去电子被氧化,n(Br2) 16g÷160g/mol="0.1mol" ,则转移的电子数目是0.2NA;Ⅱ.(1)小明运用化学实验证明了久置于空气中的亚硫酸钠已变质,用化学方程式表示亚硫酸钠变质的原因是2Na2SO3+O2=2Na2SO4, (2)FeSO4溶液用稀H2SO4酸化,放置一段时间后略显黄色,则在变化过程的离子方程式是4Fe2++4H++O2=4Fe3++2H2O;然后向其中滴加KI-淀粉溶液变蓝色,则Fe3+把I-氧化为I2,I2遇淀粉溶液变为蓝色,该变化过程的离子方程式是2Fe3++ 2I-= 2Fe2++ I2。
考点:考查离子存在的检验、离子共存、氧化还原反应方程式的书写及离子浓度的计算的知识。
本题难度:困难
2、填空题 (10分)(1)人体血液是胶体溶液。若有人不慎手指被划破,可以从急救箱中取FeCl3应急止血,其原因是 ,其主要反应的离子方程式为 。
(2)在一反应体系中,有反应物和生成物的粒子共六种:SO42-、I2、H+、SO32-、I-、H2O。已知,反应中I2只发生如下过程I2→I-,请回答。①该反应中的还原剂是 (填分子或离子符号)
②写出该反应的离子方程式 .
③若利用该反应原理进行滴定操作,则应选择的指示剂为 (填序号)
A.淀粉溶液 B.酚酞溶液 C.甲基橙
参考答案:(1)FeCl3是电解质,同时也发生水解生成带正电荷的Fe(OH)3胶体微粒,使血液凝聚, Fe3++ 3H2O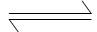 Fe(OH)3+3H+。(2)SO32-(填分子或离子符号)
Fe(OH)3+3H+。(2)SO32-(填分子或离子符号)
② I2+ SO32-+ H2O = 2I-+ SO42-+ 2H+ 。③ A (填序号)
本题解析:略
本题难度:一般
3、选择题 下列离子方程式书写正确的是( )
A.石灰乳与Na2CO3溶液混合:Ca2++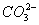
 CaCO3↓
CaCO3↓
B.NH4HSO3溶液与足量NaOH溶液混合加 91eXaM.org热: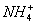 +
+ +2OH-
+2OH- NH3↑+
NH3↑+ +2H2O
+2H2O
C.酸性条件下KIO3溶液与KI溶液反应生成I2: +5I-+3H2O
+5I-+3H2O 3I2+6OH-
3I2+6OH-
D.AgNO3溶液中加入过量氨水:Ag++NH3?H2O AgOH↓+
AgOH↓+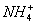

 2SO2+2H2O
2SO2+2H2O