微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一密闭容器中,400℃时存在一个化学平衡。反应进行至2?min、4?min时,分别只改变了某一条件,容器中四种物质的物质的量n?(mol)随时间t?(min)变化如图,下列说法不正确的
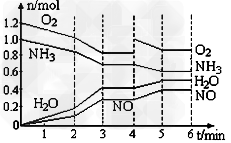
[? ]
A.平衡涉及反应为4NH3+5O2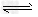 4NO+6H2O?
4NO+6H2O?
B.0至3分钟气体的平均分子量在逐步减小
C.第4至5分钟平衡在右移,NH3的转化率提高
D.2?min、4?min时改变条件可能为降温、加入O2
参考答案:D
本题解析:
本题难度:一般
2、选择题 对化学反应限度的叙述,不正确的是( )
A.任何可逆反应都有一定的限度
B.化学反应达到限度时,正逆反应速率相等
C.达到化学平衡状态也就达到化学反应的最大限度
D.化学反应的限度是不可改变的
参考答案:A.可逆反应不可能完全转化,当正逆反应速率相等时,达到反应限度,故A正确;
B.当达到化学反应限度时,正逆反应速率相等,反应物的浓度和生成物的浓度不再改变,故B正确;
C.一定条件下的化学反应,当达到平衡状态时,各物质的浓度、物质的量等不再发生改变,即达到了化学反应的最大限度,故C正确;
D.当外界条件发生改变,平衡发生移动,化学反应限度变化,故D错误.
故选D.
本题解析:
本题难度:简单
3、填空题 已知2SO2(g)+O2(g) 2SO3(g);△H<0的实验数据如下表:
2SO3(g);△H<0的实验数据如下表:
温度
| 不同压强下SO2的转化率(%)
|
1×105Pa
| 5×105Pa
| 1×106Pa
| 5×106Pa
| 1×107Pa
|
450℃
| 97.5
| 98.9
| 99.2
| 99.6
| 99.7
|
550℃
| 85.6
| 92.9
| 94.9
| 97.7
| 98.3
|
(1)应选的温度是?。
(2)应采用的压强是?,理由是?。
(3)在合成的SO3过程中,不需要分离出SO3的原因是?。
参考答案:(1)450℃;(2)1×105Pa?因为常压下SO2的转化率已经很高,若采用较大的压强,SO2的转化率提高很少,但需要动力更大,对设备的要求更高;(3)因为SO2的转化率比较高,达到平衡后的混合气体中SO2的余量很少,故不需要分离SO3。
本题解析:工业生产中既要考虑反应速率快,又要考虑原料转化率高,同时也要考虑实现条件的限制。当它们出现矛盾时,两者都要兼顾,特别要适应催化剂的活性。该反应与合成氨相似,但实际情况又不完全相同,故解题时应理论联系实际,依据合成SO3的实验数据来解答。该反应与合成氨的反应相似:都是气体体积缩小的放热反应,温度升高有利于加快反应速率,但降低了反应物的转化率,适宜的条件的选择需要综合考虑。增大压强有利于加快反应速率,同时也提高了反应物的转化率,但压强对SO2的转化率影响不大,同时加压需要动力因素、设备耐压因素,综合经济效益,生产过程中采用在常压下进行最合理。由于SO2的转化率比较高,达到平衡后的混合气体中SO2的余量很少,故不需要分离SO3。
本题难度:一般
4、填空题 (12分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.5molSO2(g)和0.48molO2(g)放入容积为1L的密闭容器中,反应: 2SO2(g)+O2(g)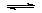 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
(2)若锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,产生的SO3与水全部化合生成H2SO4,放出26.06kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)将黄铁矿的煅烧产物Fe3O4溶于稀H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其目的是 。
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐,写出有关反应的化学方程式: 、 。
SO2既可作为生产硫酸的原料循环再利用,也可用于海水提溴过程中吸收潮湿空气中的Br2,则SO2吸收Br2的离子方程式是 。
参考答案:(1)96% (2)SO3(g)+ H2O(l)=H2SO4(l) △H=-130.3KJ/mol;
(3)抑制Fe2+或Fe3+的水解,并防止Fe2+被氧化成Fe3+;
(4)SO2+2NH3+H2O=(NH4)2SO3、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O、SO2+Br2+2H2O=4H++2Br-+SO42-
本题解析:
(1) 2SO2(g)+O2(g)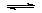 2SO3(g)
2SO3(g)
起始浓度(mol/L) 0.5 0.48 0
转化浓度(mol/L 0.48 0.24 0.48
平衡浓度(mol/L) 0.02 0.24 0.48
由以上所列三段式可知,SO2的平衡转化率为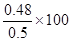 %=96%;
%=96%;
(2)锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,依据硫元素守恒,n(S)=2n(FeS2)=
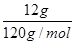 ×2=0.2mol,产生的0.2mol SO3与水全部化合生成H2SO4,放出26.06kJ热量,则1mol SO3与水全部化合生成H2SO4,放出130.3kJ热量,SO3气体转化为H2SO4的热化学方程式为:SO3(g)+ H2O(l)=H2SO4(l) △H=-130.3KJ/mol;
×2=0.2mol,产生的0.2mol SO3与水全部化合生成H2SO4,放出26.06kJ热量,则1mol SO3与水全部化合生成H2SO4,放出130.3kJ热量,SO3气体转化为H2SO4的热化学方程式为:SO3(g)+ H2O(l)=H2SO4(l) △H=-130.3KJ/mol;
(3)Fe3O4溶于稀H2SO4后,生成的Fe2+或Fe3+易水解,要加入稀H2SO4,抑制Fe2+或Fe3+水解;Fe2+易被氧化成Fe3+,故应加入铁粉防止氧化;
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,反应的化学方程式为:SO2+2NH3+H2O=(NH4)2SO3、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O;
SO2吸收Br2的离子方程式为:SO2+Br2+2H2O=4H++2Br-+SO42-
考点:考查热化学方程式的书写,化学平衡的计算应用,化学方程式离子方程式书写
点评:本题考查了热化学方程式的书写,化学平衡的计算应用,化学方程式和离子方程式书写方法,难度中等。掌握基础是解决本题的关键。
本题难度:困难
5、计算题 (7分)一定温度下,物质的量浓度分别为2mol/L和1.5mol/L的SO2(g)和O2(g)在密闭容器中发生反应:2SO2(g)+ O2(g) 2SO3(g),4min后反应达到平衡状态,测得容器中SO2(g)的转化率为60%,试求,在该温度下:
2SO3(g),4min后反应达到平衡状态,测得容器中SO2(g)的转化率为60%,试求,在该温度下:
(1)用SO2表示的平均反应速率;
(2)平衡时O2的转化率;
(3)此反应的平衡常数。
参考答案:
本题解析:(共7分)由题可知,SO2的变化浓度为2mol·L-1×60%=1.2mol·L-1,则O2和SO3的变化浓度分别为0.6mol·L-1和1.2mol·L-1,则:
2SO2(g) +? O2(g)  2SO3(g)
2SO3(g)
起始时各物质浓度/mol·L-1? 2? 1.5? 0
各物质变化浓度/mol·L-1? 1.2? 0.6? 1.2?
平衡时各物质浓度/mol·L-1? 0.8? 0.9? 1.2?(1分)
(1)v(SO2)=1.2mol·L-1÷4min=0.3 mol·L-1·min-1? ?(2分)
?(2分)
(2)O2的转化率为0.6mol·L-1÷1.5mol·L-1×100%="40%?" (2分)
(3) (2分)
(2分)
本题难度:一般