微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)进入2013年以来,我国中东部地区多次遭遇大范围、长时间的雾霾天气。车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。
(1)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
 物质 物质
T/℃ n/mol
| 活性炭
| NO
| E
| F
|
初始
| 2.030
| 0.10
| 0
| 0
|
T1
| 2.000
| 0.040
| 0.030
| 0.030
|
T2
| 2.005
| 0.050
| 0.025
| 0.025
|
①结合上表数据,写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数K1= 。
③根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2 b.T1<T2 c.无法比较
(2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:2CO+2NO N2+2CO2在一体积为1L的密闭容积中,加入0.40mol的CO和0.40mol的NO ,反应中N2的物质的量浓度的变化情况如图所示,回答下列问题。
N2+2CO2在一体积为1L的密闭容积中,加入0.40mol的CO和0.40mol的NO ,反应中N2的物质的量浓度的变化情况如图所示,回答下列问题。
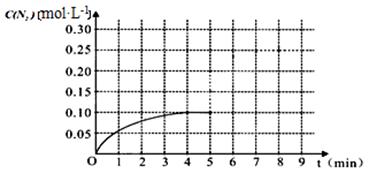
①计算从反应开始到平衡时,平均反应速率v(N2)= 。
②在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时N2的浓度约为0.25 mol·L-1)。请在上图中画出第5分钟末到此平衡时N2浓度的变化曲线。
参考答案:(1)①C + 2NO  N2 + CO2(2分)②
N2 + CO2(2分)②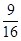 或0.56(2分)③c(2分)
或0.56(2分)③c(2分)
(2)①0.025 mol·L-1·min-1 (2分) ②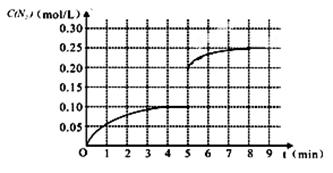
【2分;起点在(5,0.20),平衡点到(8,0.25)即给2分,是否延长不作要求】
本题解析:(1)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,故反应方程式为:C+2NO N2+CO2;
N2+CO2;
②从表中数据可知T1℃时的平衡浓度c(NO)=0.04mol÷2L=0.02mol/L,c(N2)=c(CO2)=0.03mol÷2L=0.015mol/L,故T1℃时该反应的平衡常数为K1=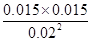 =
=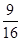 ;
;
③由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:c;
(2)①v(N2)=0.10mol/L÷4min=0.025mol/(L?min);
②把容器的体积缩小一半的瞬间氨气的浓度,氨气的浓度变为0.20mol/L,平衡后浓度约为0.25mol/L,
故答案为: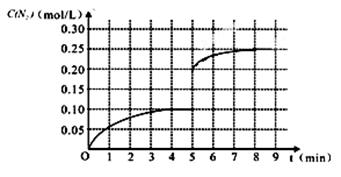 。
。
考点:考查化学平衡图象、化学反应速率、影响化学平衡的因素等
本题难度:困难
2、填空题 (9分)已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
温度
| K1
| K2
|
973 K
| 1.47
| 2.38
|
1173 K
| 2.15
| 1.67
|
请填空:
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)
参考答案:
本题解析:
本题难度:困难
3、填空题 向一恒容密闭容器中加入2 mol A、1 molB和0.6mol C三种气体。一定条件下发生反应,各物质的浓度随时间的变化如图1所示。图2为t2时刻后改变反应条件,反应速率随时间的变化情况,在t2、t3、t4、t5时刻各改变一种不同的条件,已知t3时刻为使用催化剂。
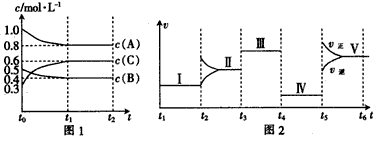
(1)写出该反应的化学方程式:_________________。
(2)若t1=15 min,则t0-t1阶段的反应速率为v(C)=_________。
(3)t4时刻改变的条件为_________。
(4)t5时刻改变的条件是_________,该反应的正反应为_________(填“吸热”或“放热”)反应。
(5)t3时该反应的平衡常数K=_________(保留三位有效数字)。
参考答案:(1)2A+B 3C
3C
(2)0.02 mol·L-1·min-1
(3)减小压强
(4)升高温度;吸热
(5)0.844
本题解析:
本题难度:一般
4、选择题 一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)?3C(g),若反应开始时充入2mo lA和2mol B,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A.1mol?C?和2mol?B
B.2mol A、1mol B和1mol He(不参加反应)
C.1mol B和1mol C
D.2mol A、3mol B和3mol C
参考答案:A.1molC和2molB,相当于是反应开始时充入23molA和(2+13)molB,平衡后A的体积分数小于a%,故A错误;
B、加入2molA和1molB相当于减小了B的投入量,化学平衡会向左进行,平衡后A的体积分数大于a%,故B正确;
C、1molB和1molC相当于反应开始时充入23molA和(1+13)molB,平衡后A的体积分数小于a%,故C错误;
D、2molA、3molB和3molC,相当于是反应开始时充入4molA和4molB,相当于增大压强,平衡不移动,平衡后A的体积分数等于a%,故D错误.
故选B.
本题解析:
本题难度:简单
5、填空题 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)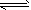 CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表
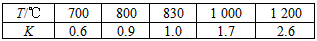
回答下列问题:
(1)该反应为________反应(填“吸热”“放热”)。
(3)能判断该反应是否已达化学平衡状态的依据是________。
a.容器中压强不变 b.混合气体中c(CO)不变 c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,在2 L的密闭容器中,加入1 mol CO2和1 mol H2充分反应达平衡时,CO平衡浓度为
0.25 mol/L,试判断此时的温度为________℃。
(4)若在(3)所处的温度下,在1 L的密闭容器中,加入2 mol CO2和3 mol H2充分反应达平衡时,H2的物质的量为________。
a.等于1.0 mol b.大于1.0 mol c.大于0.5 mol d.无法确定
参考答案:(1)吸热
(2)bc
(3)830
(4)b
本题解析:
本题难度:一般