微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下,反应A(g)+2B(g) 3C(g)达到平衡的标志是:
3C(g)达到平衡的标志是:
A、容器内压强不再变化
B、单位时间内生成nmolA同时生成2nmolB
C、A、B、C浓度不再变化
D、A、B、C的分子数之比为1:2:3
2、选择题 关于化学平衡常数、电离平衡常数、水的离子积常数和溶解平衡常数,下列说法正确的是( )
A.四种平衡常数都是一个比值,没有单位
B.四种平衡常数都是温度的函数,温度升高其值都增大
C.一个化学反应的平衡常数与物质的计量数无关
D.对于同类型反应,化学平衡常数K的大小反映了化学反应可能进行的程度
3、选择题 关于下列四个说法正确的是
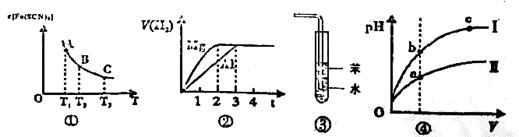
A.已知图①是体系Fe3++3SCN-=Fe(SCN)3中c[Fe(SCN)3]与温度T的平衡图像,则A点与B点相比,A点的Fe3+浓度大
B.图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V(H2) 与时间t的关系。则反应中镁和铝的反应速率之比为2 : 3
C.图③可用于吸收HCl气体,并防倒吸
D.图④是某温度下,相同体积,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线。II为醋酸稀释时pH的变化曲线
4、简答题 一定温度下,在容积为V?L的密闭容器中进行反应,M、N两种气体的物质的量随时间的变化曲线如图所示:
(1)该反应的反应物是______.
(2)该反应的化学反应方程式为:______;
(3)t1到t2时刻,以M的浓度变化表示的平均反应速率为:______
(4)若达到平衡状态的时间是2?min,N物质的平均反应速率为1.5mol?L-1?min-1,则此容器的容积为V=______L.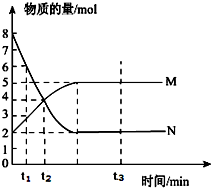
5、填空题 分碳和氮的许多化合物在工农业生产和生活中有重要的作用。
(1)工业上生产硝酸所需要的一氧化氮常用氨气来制备,该反应的化学方程式为 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s) △H="-l59.5" kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H="+116.5" kJ·mol-1
③H2O(1)=H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(3)以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为 ;每消耗3.4g NH3转移的电子数为 (阿伏加德罗常数的值用NA表示)。
(4)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H="Q" kJ·mol-1。
N2(g)+CO2(g) △H="Q" kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(Min)
浓度(mol·L-1)
| 0
| 10
| 20
| 30
| 40
| 50
|
NO
| 1.00
| 0.58
| 0.40
| 0.40
| 0.48
| 0.48
|
N2
| 0
| 0.21
| 0.30
| 0.30
| 0.36
| 0.36
|
CO2
| 0
| 0.21
| 0.30
| 0.30
| 0.36
| 0.36
|
①T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通人一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q 0(填“>”或“<”)。